Τύποι Χημικών Αντιδράσεων
Μια χημική αντίδραση είναι μια διαδικασία ή μια χημική αλλαγή που μετατρέπει ένα σύνολο ουσιών (τα αντιδρώντα) σε ένα άλλο σύνολο ουσιών (τα προϊόντα). Η διαδικασία περιλαμβάνει το σπάσιμο των χημικών δεσμών μεταξύ των ατόμων και το σχηματισμό νέων δεσμών, επομένως ο αριθμός και ο τύπος των ατόμων είναι ίδιοι τόσο για τα αντιδρώντα όσο και για τα προϊόντα. Η χημική αλλαγή περιγράφεται με μια χημική εξίσωση. Υπάρχουν διάφοροι τύποι χημικών αντιδράσεων. Ακολουθεί μια ματιά στους τέσσερις κύριους τύπους χημικών αντιδράσεων, καθώς και στους πρόσθετους βασικούς τύπους αντιδράσεων.
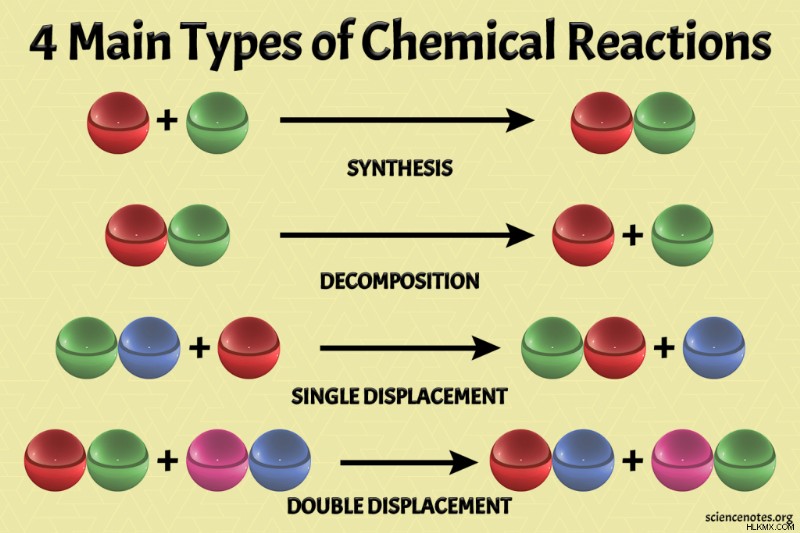
4 Κύριοι τύποι χημικών αντιδράσεων
Λάβετε υπόψη ότι υπάρχουν διαφορετικά ονόματα για τους τύπους αντίδρασης. Οι τέσσερις κύριοι τύποι χημικών αντιδράσεων είναι:
- Αντιδράσεις σύνθεσης ή συνδυασμού
- Αντιδράσεις αποσύνθεσης ή ανάλυσης
- Αντιδράσεις απλής αντικατάστασης, μονής μετατόπισης ή αντικατάστασης
- Διπλή αντικατάσταση, διπλή μετατόπιση ή αντιδράσεις μετάθεσης
Ωστόσο, υπάρχουν πολλοί άλλοι τύποι αντιδράσεων. Αυτός ο πίνακας συνοψίζει ορισμένα βασικά σημεία των κύριων τύπων χημικών αντιδράσεων:
| Τύπος αντίδρασης | Γενική Αντίδραση | Επεξήγηση |
| Σύνθεση ή συνδυασμός | A + B → AB | Δύο ή περισσότερα στοιχεία ή ενώσεις συνδυάζονται για να σχηματίσουν μία ένωση. |
| Αποσύνθεση ή ανάλυση | AB → A + B | Ένα πολύπλοκο μόριο διασπάται σε απλούστερα. |
| Μετατόπιση, Αντικατάσταση ή Αντικατάσταση | A + BC → AC + B | Ένα στοιχείο αντικαθιστά ένα άλλο σε μια σύνθεση. |
| Διπλή μετατόπιση, Διπλή αντικατάσταση ή Μετάθεση | AB + CD → AD + CB | Συνεργάτες ανταλλαγής κατιόντων και ανιόντων. |
| Κύση | A + O2 → H2 O + CO2 | Μια ένωση ενώνεται με το οξυγόνο για να σχηματίσει ένα οξείδιο. Συχνά, σχηματίζεται διοξείδιο του άνθρακα και νερό. |
| Οξινοβάση ή εξουδετέρωση | Οξύ + Βάση → Αλάτι + Νερό | Ένα οξύ και μια βάση αντιδρούν για να σχηματίσουν άλας και νερό. |
| Κατοχετεύσεις | A + Διαλυτό άλας B → Καθίζημα + διαλυτό αλάτι C | Δύο διαλύματα διαλυτών αλάτων αντιδρούν για να σχηματίσουν ένα αδιάλυτο άλας (ένα ίζημα). |
Ας ρίξουμε μια πιο προσεκτική ματιά στους τύπους αντιδράσεων και ας πάρουμε παραδείγματα:
Αντίδραση σύνθεσης ή άμεσης συνδυασμού
Σε μια αντίδραση σύνθεσης, άμεσου συνδυασμού ή σύνθεσης, δύο (ή περισσότερα) αντιδρώντα συνδυάζονται για να σχηματίσουν ένα πιο πολύπλοκο προϊόν. Η γενική μορφή της αντίδρασης είναι:
Α + Β → ΑΒ
Ένα παράδειγμα αντίδρασης σύνθεσης είναι ο συνδυασμός σιδήρου και θείου για να σχηματιστεί θειούχος σίδηρος (II):
8 Fe + S8 → 8 FeS
Ακολουθούν άλλα παραδείγματα αντιδράσεων σύνθεσης:
- 2 Na(s) + Cl2 (ζ) → 2 NaCl(s)
- C(s) + O2 (ζ) → CO2 (ζ)
- S(s) + O2 (ζ) → SO2 (ζ)
- 2 Fe(s) + O2 (ζ) → 2 FeO(s)
- 2 SO2 + O2 → 2 SO3
- 6 C + 3 H2 → C6 H6
- 4 Na + 2 C + 3 O2 → 2 Na2 CO3
Αντίδραση αποσύνθεσης ή ανάλυσης
Μια ένωση σπάει ή αποσυντίθεται σε μικρότερα κομμάτια σε μια αντίδραση χημικής αποσύνθεσης ή ανάλυσης. Η γενική μορφή της αντίδρασης είναι:
ΑΒ → Α + Β
Ένα παράδειγμα αντίδρασης αποσύνθεσης είναι η ηλεκτρόλυση του νερού για να σχηματιστεί οξυγόνο και υδρογόνο:
2 H2 O → 2 H2 + O2
Ακολουθούν πρόσθετα παραδείγματα αντιδράσεων αποσύνθεσης:
- CaCO3 → CaO + CO2
- 2 KClO3 → 2 KCl + 3 O2
- Να2 CO3 → Na2 O + CO2
Μία αντίδραση αντικατάστασης, απλή μετατόπιση ή αντίδραση αντικατάστασης
Μια απλή αντίδραση αντικατάστασης, απλής μετατόπισης ή υποκατάστασης είναι όταν ένα στοιχείο μετατοπίζεται από ένα αντιδρών για να σχηματίσει μια ένωση με ένα άλλο στοιχείο. Η αντίδραση έχει τη γενική μορφή:
A + BC → AC + B
Ένα παράδειγμα μιας απλής αντίδρασης αντικατάστασης είναι όταν ο ψευδάργυρος συνδυάζεται με υδροχλωρικό οξύ για να σχηματίσει χλωριούχο ψευδάργυρο και υδρογόνο. Ο ψευδάργυρος αντικαθιστά ή εκτοπίζει το υδρογόνο στο υδροχλωρικό οξύ:
Zn + 2 HCl → ZnCl2 + H2
Διπλή αντικατάσταση, διπλή μετατόπιση ή αντίδραση μετάθεσης
Όταν τα αντιδρώντα κατιόντα και τα ανιόντα «ανταλλάσσουν εταίρους», η αντίδραση ονομάζεται αντίδραση διπλής αντικατάστασης, διπλής μετατόπισης ή μετάθεσης. Η γενική μορφή για μια αντίδραση διπλής αντικατάστασης είναι:
AB + CD → AD + CB
Ένα παράδειγμα αντίδρασης διπλής αντικατάστασης είναι η αντίδραση μεταξύ χλωριούχου νατρίου και νιτρικού αργύρου για να δώσει νιτρικό νάτριο και χλωριούχο άργυρο:
NaCl(aq) + AgNO3 (aq) → NaNO3 (aq) + AgCl(s)
Αντίδραση καύσης
Μια αντίδραση καύσης είναι η αντίδραση μεταξύ ενός καυσίμου και του οξυγόνου για να σχηματιστεί ένα ή περισσότερα οξείδια. Επειδή πολλά καύσιμα έχουν βάση τον άνθρακα, το διοξείδιο του άνθρακα (CO2 ) είναι συχνά προϊόν. Μερικές φορές νερό (H2 O) είναι ένα προϊόν.
Ακολουθούν παραδείγματα αντιδράσεων καύσης και οι ισορροπημένες εξισώσεις τους:
- C10 H8 + 12 O2 → 10 CO2 + 4 H2 O
- H2 + O2 → 2 H2 O
- C6 H12 O6 + 6 O2 → 6 CO2 + 6 H2 O
- 2 Fe2 S3 + 9 O2 → 2 Fe2 O3 + 6 SO2
- 2 Al2 S3 + 9 O2 → 2 Al2 O3 + 6 SO2
- P4 + 5 O2 → 2 P2 O5
Αντίδραση οξέος-βάσης ή εξουδετέρωσης
Μια αντίδραση οξέος-βάσης είναι ένας τύπος αντίδρασης διπλής αντικατάστασης που συμβαίνει μεταξύ ενός οξέος και μιας βάσης. Το ιόν Η στο οξύ αντιδρά με το ιόν ΟΗ στη βάση σχηματίζοντας νερό και ένα ιοντικό άλας:
HA + BOH → H2 Ο + ΒΑ
Η αντίδραση μεταξύ υδροβρωμικού οξέος (HBr) και υδροξειδίου του νατρίου είναι ένα παράδειγμα αντίδρασης οξέος-βάσης:
HBr + NaOH → NaBr + H2 O
Αντίδραση οξείδωσης-αναγωγής ή οξειδοαναγωγής
Το Redox σημαίνει μείωση και οξείδωση. Οι δύο διαδικασίες συμβαίνουν μαζί. Αυτός ο τύπος αντίδρασης περιλαμβάνει μεταφορά ηλεκτρονίων μεταξύ των αντιδρώντων και αλλαγή στον αριθμό οξείδωσης. Ένα παράδειγμα είναι η μείωση του I2 για σχηματισμό I και οξείδωση του S2 O3 (θειοθειικό ανιόν) για σχηματισμό S4 O6 :
2 S2 O3 (aq) + I2 (aq) → S4 O6 (aq) + 2 I(aq)
Αντίδραση ισομερισμού
Σε μια αντίδραση ισομερισμού, η δομική διάταξη μιας ένωσης αλλάζει αλλά η καθαρή ατομική της σύνθεση παραμένει η ίδια.
Για παράδειγμα:
CH3 CH2 CH2 CH3 (n-βουτάνιο) → CH3 CH(CH3 )CH3 (i-βουτάνιο)
Αντίδραση υδρόλυσης
Μια αντίδραση υδρόλυσης είναι μια αντίδραση κατά την οποία ένα ή περισσότερα μόρια νερού προστίθενται σε μια ουσία. Σε ορισμένες περιπτώσεις, αυτό προκαλεί διάσπαση τόσο της ουσίας όσο και του μορίου του νερού. Η γενική μορφή μιας αντίδρασης υδρόλυσης είναι:
X(aq) + H2 O(l) ↔ HX(aq) + OH(aq)
Η αντίστροφη αντίδραση είναι μια αντίδραση συμπύκνωσης. Σε μια αντίδραση συμπύκνωσης, το νερό αφαιρείται από μια ουσία.
Πόσοι τύποι χημικών αντιδράσεων υπάρχουν;

Τεχνικά, υπάρχουν εκατοντάδες ή και χιλιάδες διαφορετικοί τύποι χημικών αντιδράσεων. Ωστόσο, οι μαθητές της χημείας συνήθως μαθαίνουν να τα ταξινομούν σε 4 κύριους τύπους, 5 κύριους τύπους ή 6 κύριους τύπους. Οι τέσσερις κύριοι τύποι χημικών αντιδράσεων είναι η σύνθεση, η αποσύνθεση, η απλή μετατόπιση και η διπλή μετατόπιση. Αλλά, θυμηθείτε, μερικοί άνθρωποι χρησιμοποιούν διαφορετικά ονόματα για αυτές τις αντιδράσεις. Άλλοι σημαντικοί τύποι αντιδράσεων είναι οι αντιδράσεις καύσης, οξέος-βάσης και οξειδοαναγωγής. Γίνεται ακόμη πιο περίπλοκο στην οργανική χημεία, όπου πολλές αντιδράσεις έχουν ειδικά ονόματα. Ωστόσο, αυτοί οι άλλοι τύποι αντιδράσεων ταιριάζουν επίσης σε μία από τις τέσσερις κύριες κατηγορίες!
Φύλλο εργασίας Τύποι χημικών αντιδράσεων
Εξασκηθείτε στον εντοπισμό των τεσσάρων κύριων τύπων χημικών αντιδράσεων με αυτό το φύλλο εργασίας. Κατεβάστε και εκτυπώστε το φύλλο εργασίας PDF και το κλειδί απάντησης.
[Φύλλο εργασίας Τύποι χημικών αντιδράσεων ] [Κλειδί απάντησης PDF ]
Αναφορές
- Atkins, Peter W.; Julio de Paula (2006). Φυσική χημεία (4η έκδ.). Weinheim:Wiley-VCH. ISBN 978-3-527-31546-8.
- IUPAC (1997). "Χημική αντίδραση". Σύνοψη Χημικής Ορολογίας (2η έκδ.) (το «Χρυσό Βιβλίο»). doi:10.1351/goldbook.C01033
- Myers, Richard (2009). Τα Βασικά της Χημείας . Greenwood Publishing Group. ISBN 978-0-313-31664-7.
- Wiberg, Egon; Wiberg, Nils; Holleman, Arnold Frederick (2001). Ανόργανη Χημεία . Ακαδημαϊκός Τύπος. ISBN 978-0-12-352651-9.