Αρωματικές Ενώσεις
Βασικές έννοιες
Σε αυτό το σεμινάριο, θα μάθετε τι κάνει μια ένωση αρωματική, τη δύναμη της αρωματικότητας, κοινά παραδείγματα αρωματικότητας, αντιαρωματικές ενώσεις και σημαντικές αντιδράσεις αρωματικού δακτυλίου.
Θέματα που καλύπτονται σε άλλα άρθρα
- Λειτουργικές ομάδες
- Μοριακή Γεωμετρία
- Συντονισμός
- Θεωρία Μοριακής Τροχίας
Λεξιλόγιο
- Αρωματικές:Κυκλικές, επίπεδες δομές που έχουν ένα συνεχές συζευγμένο σύστημα και ικανοποιούν το νόμο του Hückel.
- Αντιαρωματικά:Κυκλικές, επίπεδες δομές που έχουν ένα συνεχές, συζευγμένο σύστημα και έχουν 4n ηλεκτρόνια.
- Νόμος του Hückel:Περιγράφει μια δομή με ηλεκτρόνια 4n + 2 pi
Αρωματικότητα
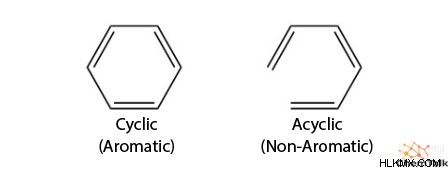
Οι αρωματικές ενώσεις αποτελούνται από ενώσεις που είναι κυκλικές, διαθέτουν συζευγμένο σύστημα, ικανοποιούν το νόμο του Huckel και είναι συνήθως επίπεδες.
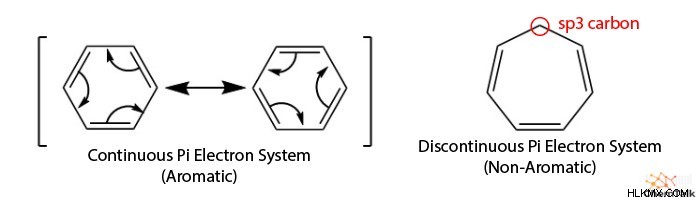
Όπως υποδηλώνει το όνομα, οι κυκλικές δομές σχηματίζουν δακτυλίους, σε αντίθεση με τις δομές διακλαδούμενης αλυσίδας. Εκτός από το σχήμα του δακτυλίου, η αρωματικότητα περιλαμβάνει ένα συνεχές σύστημα pi. Αυτό σημαίνει ότι κάθε άτομο με τον δακτύλιο έχει διαθέσιμο p τροχιακό ή είναι sp υβριδισμένο. έτσι σταθεροποιείται ο συντονισμός.
Ο νόμος του Hückel δηλώνει ότι οι αρωματικές ενώσεις πρέπει να έχουν ηλεκτρόνια 4n + 2 pi (2, 6, 10, 14, κ.λπ.). Τα ηλεκτρόνια Pi είναι ηλεκτρόνια που συμμετέχουν σε δεσμούς pi, που φαίνονται σε διπλούς και τριπλούς δεσμούς και αποτελούν μέρος ενός τροχιακού p. Το 4n +2 παρέχει τον αριθμό των ηλεκτρονίων pi που σχετίζονται με την αρωματικότητα, όχι πώς να υπολογίσετε τον αριθμό των ηλεκτρονίων pi μέσα σε έναν δακτύλιο.
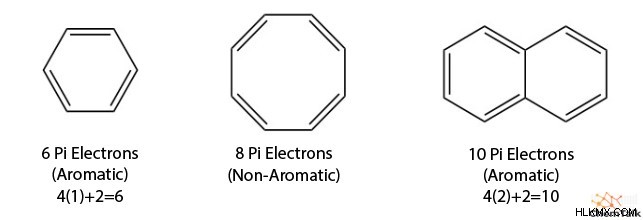
Για να προσδιορίσετε τον αριθμό των ηλεκτρονίων pi σε έναν δακτύλιο, μετρήστε τον αριθμό των διπλών δεσμών, των αρνητικών φορτίων και των μεμονωμένων ζευγών που συμβάλλουν στο σύστημα pi. Στη συνέχεια, πολλαπλασιάστε με 2.
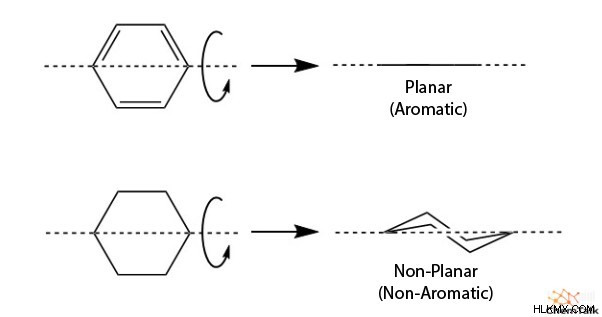
Τα επίπεδα μόρια είναι μόρια που είναι επίπεδα ως αποτέλεσμα κάθε ατόμου να βρίσκεται στο ίδιο επίπεδο. Στην περίπτωση των αρωματικών ενώσεων, κάθε άτομο υβριδίζεται sp. επομένως, είναι επίπεδα. Ανά θεωρία δεσμού σθένους, η δομή του δακτυλίου πρέπει να είναι επίπεδη ώστε τα τροχιακά p να επικαλύπτονται και να επιτρέπει τη συνεχή κίνηση των ηλεκτρονίων.
Η δύναμη του αρωματικού Δαχτυλίδια
Όταν συνδυάζεται καθένας από αυτούς τους 4 παράγοντες, το αποτέλεσμα είναι μια δομή πολύ πιο σταθερή από το άθροισμα κάθε παράγοντα. Για να το δείξουμε αυτό, ας παρατηρήσουμε την αλλαγή στην ενθαλπία που σχετίζεται με το πλήρως υδρογονούμενο βενζόλιο. Συγκεκριμένα, αυτό περιλαμβάνει την αντίδραση αερίου υδρογόνου με βενζόλιο για να δώσει κυκλοεξάνιο χωρίς διπλούς δεσμούς. Όταν μετράται εμπειρικά μέσω θερμιδομετρίας, η αντίδραση είναι εξώθερμη και απελευθερώνει 208 kJ/mol.
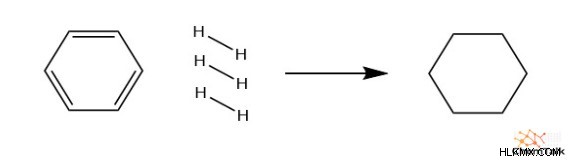
C6 H6 + H2 → C6 H12
∆Hrxn =-208 kJ/mol
Τώρα ας παρατηρήσουμε την αλλαγή της ενθαλπίας στην υδρογόνωση του κυκλοεξενίου (ένας διπλός δεσμός) και του κυκλοδιεξενίου (δύο διπλοί δεσμοί). Για έναν διπλό δεσμό, απελευθερώνονται 120 kJ/mol από την αντίδραση και για δύο διπλούς δεσμούς, απελευθερώνονται 234 kJ/mol. Μπορούμε να δούμε μια τάση όπου περίπου διπλάσια ενέργεια απελευθερώνεται από την υδρογόνωση του κυκλοεξαδιενίου από το κυκλοεξένιο.
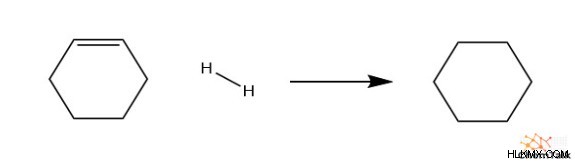
C6 H10 + H2 → C6 H12
∆Hrxn =-120 kJ/mol
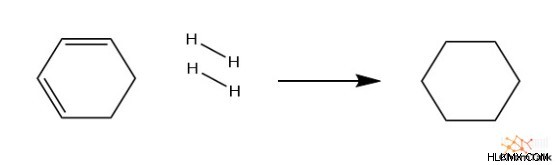
C6 H8 + H2 → C6 H12
∆Hrxn =-234 kJ/mol
Εάν το βενζόλιο ήταν απλώς κυκλοεξάνιο με τρεις διπλούς δεσμούς, θα περιμέναμε η ενθαλπία της υδρογόνωσης να είναι ίση με περίπου 360 kJ/mol για καθένα από τους τρεις διπλούς δεσμούς. Αντίθετα, όπως αναφέρθηκε, απελευθερώνονται μόνο 208 kJ/mol ενέργειας. Οι χημικοί αποκαλούν αυτή τη διαφορά 150 kJ/mol στην «ενέργεια συντονισμού» του βενζολίου, η οποία το καθιστά ουσιαστικά πιο σταθερό από το «κυκλοεξατριένιο». Όπως μπορούμε να δούμε, η αρωματικότητα παρέχει πρόσθετη σταθερότητα πέρα από αυτή που υποδεικνύεται από τη συμβατική γνώση που σχετίζεται με τη μοριακή δομή.
Παραδείγματα αρωματικών δαχτυλιδιών
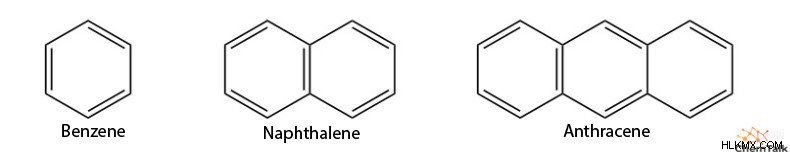
Το βενζόλιο χρησιμεύει ως το πιο αναγνωρίσιμο αρωματικό μόριο, αλλά υπάρχουν πολλές περισσότερες αρωματικές δομές. Είναι σημαντικό, αν και τα ηλεκτρόνια π πρέπει να έχουν την ικανότητα να κινούνται κυκλικά, μπορούν να υπάρχουν πολλαπλοί κύκλοι μέσα στο ίδιο αρωματικό σύστημα. Για παράδειγμα, μόρια όπως το ναφθαλίνιο και το ανθρακένιο υπολογίζονται ως αρωματικές δομές.
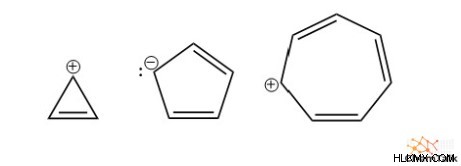
Επιπλέον, πολλές ιοντικές δομές έχουν επίσης αρωματικότητα, εφόσον ο συνολικός αριθμός ηλεκτρονίων ακολουθεί τον νόμο του Hückel. Αξιοσημείωτα παραδείγματα περιλαμβάνουν το κατιόν κυκλοπροπενυλίου, το ανιόν κυκλοπενταδιενίου και το κατιόν κυκλοεπτατριενυλίου.
Είναι ενδιαφέρον ότι, λόγω της θερμοδυναμικής ευνοϊκότητας της αρωματικότητας, μόρια όπως το κυκλοπενταδιένιο έχουν μάλλον όξινα υδρογόνα (pKa =16) συνδεδεμένα με τον sp άνθρακα τους.

Επιπλέον, οι ετεροκυκλικές ενώσεις μπορεί επίσης να έχουν αρωματικότητα, όπως το φουράνιο, η οξαζόλη και η πουρίνη.
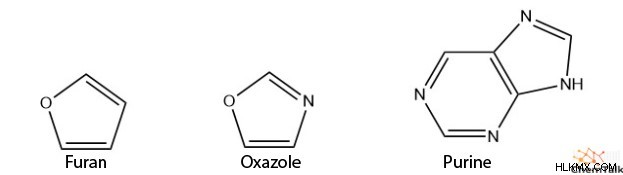
Επίσης, μπορείτε να παρατηρήσετε ότι πολλές από τις ετεροκυκλικές ενώσεις, καθώς και το ανιόν κυκλοπενταδιενίου, έχουν τέσσερα ηλεκτρόνια σε ένα από τα μέλη του δακτυλίου τους. Αν και αυτό συνήθως υποδηλώνει υβριδισμό sp, σε αυτήν την περίπτωση, αυτά τα άτομα εξακολουθούν να έχουν υβριδισμό sp, με ένα μόνο ζεύγος ηλεκτρονίων σε ένα τροχιακό p.
Αντι-Αρωματικές Ενώσεις
Ενώ η αρωματικότητα παρέχει κάποια πρόσθετη σταθερότητα, υπάρχουν επίσης παρόμοιες ενώσεις που έχουν πρόσθετη αστάθεια. Οι χημικοί αποκαλούν αυτές τις ενώσεις "αντι-αρωματικές" και όπως το σταθερό τους αντίστοιχο, έχουν μια επίπεδη, κυκλική δομή με ένα συνεχές σύστημα pi. Ωστόσο, αντί να ακολουθούν τον νόμο του Hückel, αυτές οι ενώσεις έχουν ηλεκτρόνια 4n pi. Το κλασικό παράδειγμα μιας αντι-αρωματικής ένωσης είναι το κυκλοβουταδιένιο, το οποίο είναι τόσο ασταθές που αποικοδομείται σχεδόν ακαριαία κάτω από μη ακραίες συνθήκες.

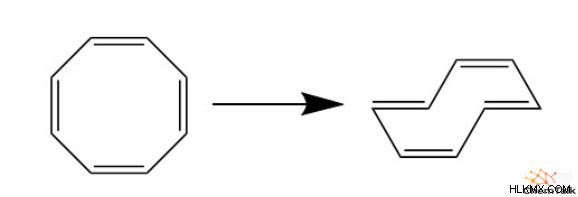
Πράγματι, μεγαλύτερες επίδοξες αντι-αρωματικές ενώσεις, όπως το κυκλοοκτατετραένιο, αναπτύσσουν αντίθετα μια δομή συσσωματώματος. Αυτό αυξάνει τη στερεοχημική παρεμπόδιση μεταξύ των ανθράκων των μελών, αλλά αυτό το pucker έχει πολύ μεγαλύτερη σταθερότητα από μια επίπεδη αντι-αρωματική δομή.
Αντιδράσεις αρωματικής υποκατάστασης
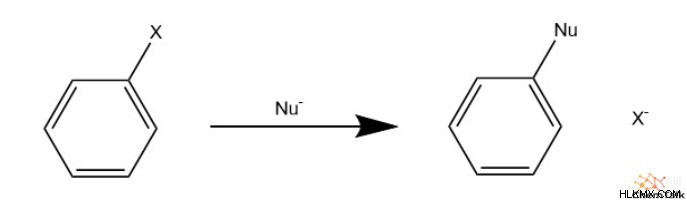
Λόγω της μοναδικής χημείας της αρωματικότητας, οι χημικοί έχουν δημιουργήσει πολλές χρήσεις για αυτά. Ωστόσο, αυτό γενικά περιλαμβάνει κάποια υποκατεστημένη αρωματική ένωση. Αυτό συμβαίνει κυρίως μέσω ηλεκτρόφιλης αρωματικής υποκατάστασης, επιτρέποντας την προσκόλληση ομάδων όπως αλογονίδια, νίτρο, ακύλια και υδρογονάνθρακες.
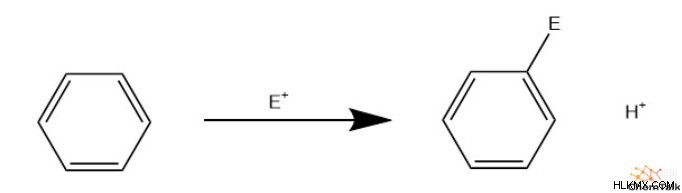
Οι υποκαταστάτες μπορούν επίσης να προσκολληθούν στον δακτύλιο μέσω πυρηνόφιλης αρωματικής υποκατάστασης. Αυτό επιτρέπει τη σύνδεση αλκοολών, αμινοξέων και άλλων.