Διαφορά μεταξύ ηλίου και υδρογόνου
Κύρια διαφορά – Ήλιο έναντι υδρογόνου
Το υδρογόνο και το ήλιο είναι τα δύο πρώτα στοιχεία που βρίσκονται στον περιοδικό πίνακα των στοιχείων. Επομένως, είναι τα μικρότερα και ελαφρύτερα άτομα στη γη. Και οι δύο είναι αέριες ουσίες. Λόγω των χαρακτηριστικών χαρακτηριστικών του υδρογόνου και του ηλίου, υπάρχουν πολλές εφαρμογές αυτών των αερίων στη βιομηχανία. Λόγω του πολύ μικρού βάρους αυτών των αερίων, χρησιμοποιούνται για την πλήρωση αερόστατων. Η κύρια διαφορά μεταξύ ηλίου και υδρογόνου είναι ότι το άτομο ηλίου υπάρχει ως μονοατομικό αέριο στην ατμόσφαιρα, ενώ το υδρογόνο υπάρχει ως διατομικό αέριο στην ατμόσφαιρα.
Βασικές περιοχές που καλύπτονται
1. Τι είναι το ήλιο
– Ιδιότητες, Ισότοπα, Αντιδράσεις και Εφαρμογές
2. Τι είναι το Υδρογόνο
– Ιδιότητες, Ισότοπα, Αντιδράσεις και Εφαρμογές
3. Ποιες είναι οι ομοιότητες μεταξύ ηλίου και υδρογόνους
– Περίληψη κοινών χαρακτηριστικών
4. Ποια είναι η διαφορά μεταξύ ηλίου και υδρογόνος
– Σύγκριση βασικών διαφορών
Βασικοί όροι:Ατομική μάζα, ατομικός αριθμός, δευτέριο , ήλιο, υδρογόνο, ισότοπα ηλίου, πρωτίου, τρίτιο 
Τι είναι το Ήλιο
Το ήλιο είναι ένα στοιχείο που έχει ατομικό αριθμό 2 και είναι αέρια ουσία. Το χημικό σύμβολο για το ήλιο είναι He. Η διάταξη ηλεκτρονίων του ηλίου είναι 1s. Το ατομικό σύμβολο του ηλίου είναι 2 Αυτός. Ένα άτομο ηλίου αποτελείται από 2 πρωτόνια και 2 νετρόνια στον πυρήνα μαζί με 2 ηλεκτρόνια στο τροχιακό του 1s. Επομένως, η ατομική μάζα του ηλίου είναι 4,002602 amu. Σε θερμοκρασία και πίεση δωματίου, το ήλιο είναι ένα άχρωμο και άοσμο αέριο. Το ήλιο θεωρείται το δεύτερο πιο άφθονο στοιχείο στο σύμπαν. Υπάρχει ως μονοατομικό αέριο.
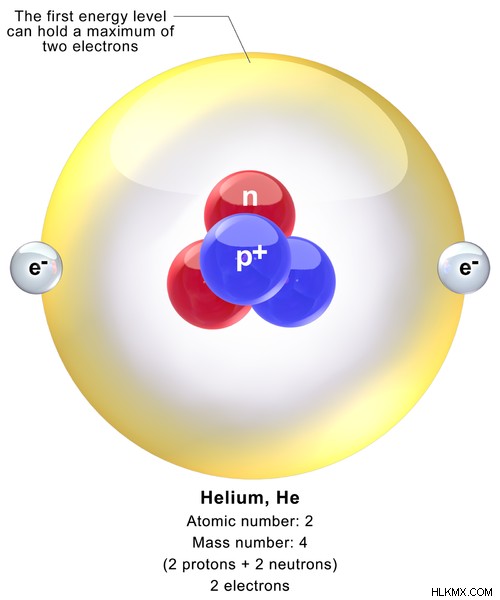
Εικόνα 1:Χημική δομή του ατόμου ηλίου
Το σημείο τήξης του ηλίου είναι περίπου -272,2 C, το οποίο είναι μια πολύ χαμηλή τιμή. Το σημείο βρασμού του ηλίου δίνεται ως -268C. Αυτό το καθιστά αέριο για μεγαλύτερο εύρος θερμοκρασιών. Στον περιοδικό πίνακα στοιχείων, το ήλιο κατηγοριοποιείται ως στοιχείο μπλοκ s αλλά τοποθετείται στη δεξιά πλευρά του πίνακα. Αυτό συμβαίνει επειδή το ήλιο είναι ένα αδρανές αέριο που δεν θα υποστεί χημικές αντιδράσεις. Είναι επίσης ένα μη μέταλλο.
Δεδομένου ότι το ήλιο είναι ευγενές αέριο, εμφανίζει μόνο μηδενική κατάσταση οξείδωσης. Υπάρχουν δύο γνωστά ισότοπα ηλίου. Είναι το ισότοπο Αυτός και το ισότοπο Αυτός. Είναι η πιο άφθονη μορφή μεταξύ τους και η αφθονία της δίνεται ως 99%. Και τα δύο αυτά ισότοπα είναι σταθερά και δεν μπορεί να παρατηρηθεί ραδιενεργή διάσπαση. Ωστόσο, υπάρχουν και άλλα ισότοπα. Είναι ασταθή και ραδιενεργά.
Το ήλιο χρησιμοποιείται ευρέως στα μπαλόνια. Επιπλέον, το ήλιο χρησιμοποιείται για την παροχή ελεγχόμενης ατμόσφαιρας για πολλές αντιδράσεις σύνθεσης (όπως η σύνθεση κρυστάλλων πυριτίου) λόγω της υψηλής αδράνειας του. Χρησιμοποιείται επίσης ως αδρανής ασπίδα για συγκόλληση τόξου. Το ήλιο μπορεί να μετατραπεί στην υγρή του μορφή, η οποία είναι γνωστή ως υγρό ήλιο και χρησιμοποιείται ως σημαντικό κρυογονικό υλικό.
Τι είναι το Υδρογόνο
Το υδρογόνο είναι ένα χημικό στοιχείο με ατομικό αριθμό 1 και δίνεται στο σύμβολο H. Ένα άτομο υδρογόνου αποτελείται από ένα πρωτόνιο και κανένα νετρόνιο στον πυρήνα. έχει ένα ηλεκτρόνιο στο 1s τροχιακό του. Η ηλεκτρονιακή διαμόρφωση του υδρογόνου δίνεται ως 1s. Το υδρογόνο είναι ένα στοιχείο μπλοκ στον περιοδικό πίνακα. Το ατομικό βάρος του υδρογόνου είναι 1,00794 amu.
Σε θερμοκρασία και πίεση δωματίου, το υδρογόνο υπάρχει ως διατομικό αέριο μόριο. Είναι αέριο άχρωμο και άοσμο. Το σημείο τήξης του υδρογόνου είναι περίπου -259C. Το σημείο βρασμού είναι περίπου -252C. Το υδρογόνο έχει τρεις καταστάσεις οξείδωσης. Είναι -1, 0 και +1. Όταν το υδρογόνο συνδέεται με ένα άτομο μετάλλου, έχει -1 κατάσταση οξείδωσης.
Υπάρχουν τρία κύρια ισότοπα υδρογόνου:το πρωτίου, το δευτέριο και το τρίτιο. Protium είναι το πιο άφθονο ισότοπο και έχει αφθονία 99%. Επομένως, όταν μιλάμε γενικά για υδρογόνο, μιλάμε για Protium. Δευτέριο είναι επίσης ένα σταθερό ισότοπο αλλά είναι λιγότερο άφθονο. Έχει ένα νετρόνιο στον πυρήνα του ενώ το Protium όχι. Τρίτιο είναι ένα ραδιενεργό ισότοπο. Επιπλέον, υπάρχουν πολλά άλλα ισότοπα που δεν είναι σταθερά και είναι εξαιρετικά ραδιενεργά.
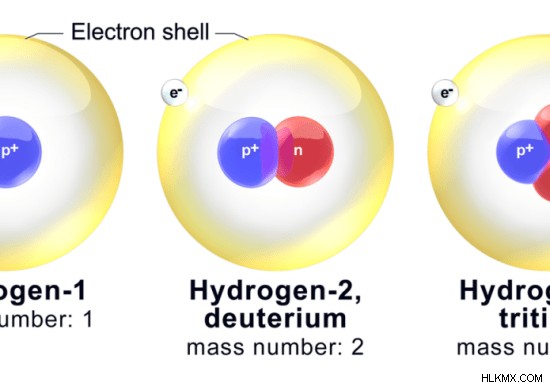
Εικόνα 2:Κύρια ισότοπα του υδρογόνου
Υπάρχουν πολλές εφαρμογές του αερίου υδρογόνου. Μεγάλες ποσότητες υδρογόνου χρησιμοποιούνται για την επεξεργασία ορυκτών καυσίμων. Το αέριο υδρογόνο χρησιμοποιείται επίσης στην παραγωγή αμμωνίας. Επιπλέον, το υδρογόνο χρησιμοποιείται ως ψυκτικό υγρό και σε σταθμούς ηλεκτροπαραγωγής.
Ομοιότητες μεταξύ ηλίου και υδρογόνου
- Το ήλιο και το υδρογόνο είναι αέριες ουσίες σε τυπικές συνθήκες θερμοκρασίας και πίεσης.
- Και τα δύο έχουν τροχιακό μόνο 1s.
- Και οι δύο είναι μικρές και ελαφριές ουσίες.
- Και τα δύο στοιχεία ανήκουν στο μπλοκ s του περιοδικού πίνακα.
- Και τα δύο είναι αμέταλλα.
Διαφορά μεταξύ ηλίου και υδρογόνου
Ορισμός
Ήλιο: Το ήλιο είναι ένα στοιχείο με ατομικό αριθμό 2 και αντιπροσωπεύεται από το σύμβολο He.
Υδρογόνο: Το υδρογόνο είναι ένα χημικό στοιχείο με ατομικό αριθμό 1 και αντιπροσωπεύεται από το σύμβολο H.
Ατομικός αριθμός
Ήλιο: Ο ατομικός αριθμός του ηλίου είναι 2.
Υδρογόνο: Ο ατομικός αριθμός του υδρογόνου είναι 1.
Ατομικό βάρος
Ήλιο: Το ατομικό βάρος του ηλίου είναι 4,002602 amu.
Υδρογόνο: Το ατομικό βάρος του υδρογόνου είναι 1,00794 amu.
Ενώσεις
Ήλιο: Το ήλιο υπάρχει ως μονατομική αέρια ουσία.
Υδρογόνο: Το υδρογόνο υπάρχει ως διατομικό αέριο μόριο.
Καταστάσεις οξείδωσης
Ήλιο: Το ήλιο έχει μόνο 0 κατάσταση οξείδωσης.
Υδρογόνο: Το υδρογόνο έχει καταστάσεις οξείδωσης -1, 0 και +1.
Ισότοπα
Ήλιο: Το ήλιο έχει δύο κύρια ισότοπα όπως He και He.
Υδρογόνο: Το υδρογόνο έχει τρία κύρια ισότοπα. Πρωτίου, δευτέριο και τρίτιο.
Σημείο τήξης
Ήλιο: Το σημείο τήξης του ηλίου είναι -272,2 C.
Υδρογόνο: Το σημείο τήξης του υδρογόνου είναι -259 C.
Συμπέρασμα
Το ήλιο και το υδρογόνο είναι χημικά στοιχεία που βρίσκονται κυρίως στην ατμόσφαιρα ως αέριες ουσίες λόγω των πολύ χαμηλών θερμοκρασιών τήξης και βρασμού τους. Η κύρια διαφορά μεταξύ ηλίου και υδρογόνου είναι ότι το άτομο ηλίου υπάρχει ως μονοατομικό αέριο στην ατμόσφαιρα, ενώ το υδρογόνο υπάρχει ως διατομικό αέριο στην ατμόσφαιρα.




