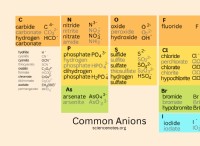
Χρησιμοποιήστε ένα διάγραμμα για να δείξετε ιόντα σχηματίζονται όταν το άτομο νατρίου έρχεται σε στενή επαφή με το άτομο χλωρίου;
Σχηματισμός χλωριούχου νατρίου (NaCl)
Ακολουθεί ένα διάγραμμα που απεικονίζει το σχηματισμό ιόντων όταν αλληλεπιδρούν τα άτομα νατρίου και χλωρίου:
Διάγραμμα:
`` `
+1 -1
Na cl
• •
• • • • •
• • • • •
Na ---> cl
• •
• • • • •
• • • • •
+1 -1
`` `
Επεξήγηση:
1. Το νάτριο έχει ένα ηλεκτρόνιο στο εξωτερικό του κέλυφος (κέλυφος σθένους). Είναι πρόθυμο να χάσει αυτό το ηλεκτρόνιο για να επιτευχθεί μια σταθερή ρύθμιση οκτάδων.
2. Το χλώριο έχει επτά ηλεκτρόνια στο κέλυφος σθένους του. Χρειάζεται ένα ακόμη ηλεκτρόνιο για να επιτύχει ένα σταθερό οκτάδα.
3. αλληλεπίδραση: Όταν τα άτομα νατρίου και χλωρίου έρχονται κοντά, το νάτριο δωρίζει εύκολα το ηλεκτρόνιο του μοναχικού σθένους στο χλώριο.
4. σχηματισμός ιόντων:
* Το άτομο νατρίου (Na) χάνει ένα ηλεκτρόνιο: Γίνεται θετικά φορτισμένο (NA+).
* Το άτομο χλωρίου (CL) κερδίζει ένα ηλεκτρόνιο: Γίνεται αρνητικά φορτισμένο (cl-).
5. Ιονικός δεσμός: Τα αντίθετα φορτισμένα ιόντα νατρίου και χλωρίου προσελκύουν ο ένας τον άλλον έντονα, σχηματίζοντας έναν ιοντικό δεσμό. Αυτή η ισχυρή ηλεκτροστατική έλξη μεταξύ των θετικών και των αρνητικών ιόντων είναι αυτό που συγκρατεί το μόριο χλωριούχου νατρίου (NaCl) μαζί.
Βασικά σημεία:
* Η μεταφορά ηλεκτρονίων από νάτριο σε χλώριο έχει ως αποτέλεσμα το σχηματισμό ιόντων.
* Το νάτριο γίνεται κατιόν (θετικά φορτισμένο ιόν) ενώ το χλώριο γίνεται ανιόν (αρνητικά φορτισμένο ιόν).
* Ο ιοντικός δεσμός είναι μια ισχυρή ηλεκτροστατική έλξη μεταξύ των αντίθετα φορτισμένων ιόντων.