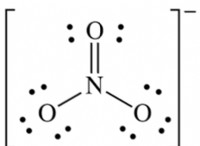
Οι ιοντικοί ή ομοιοπολικοί δεσμοί κρατούν μόρια σε ένα κρύσταλλο μοριακής ουσίας;
Μοριακές ουσίες συγκρατούνται από ομοιοπολικούς δεσμούς μέσα στο μόριο, αλλά τα ίδια τα μόρια συγκρατούνται από τις ασθενέστερες δυνάμεις που ονομάζονται διαμοριακές δυνάμεις . Αυτές οι δυνάμεις είναι ασθενέστερες από τους ομοιοπολικούς δεσμούς και μπορούν να ταξινομηθούν σε τρεις τύπους:
* Van der Waals Δυνάμεις: Αυτές είναι οι πιο αδύναμες διαμοριακές δυνάμεις και προκύπτουν από προσωρινές διακυμάνσεις στην κατανομή ηλεκτρονίων γύρω από τα μόρια. Περιλαμβάνουν τις δυνάμεις διασποράς του Λονδίνου και τις αλληλεπιδράσεις διπόλης διπόλης.
* δεσμούς υδρογόνου: Αυτά είναι ισχυρότερα από τις δυνάμεις van der Waals και εμφανίζονται όταν ένα άτομο υδρογόνου συνδέεται με ένα πολύ ηλεκτροαρνητικό άτομο (όπως το οξυγόνο ή το άζωτο) και προσελκύεται από ένα μοναδικό ζεύγος ηλεκτρονίων σε ένα γειτονικό μόριο.
* αλληλεπιδράσεις διπόλης-διπόλης: Αυτά συμβαίνουν μεταξύ πολικών μορίων και οφείλονται στην έλξη μεταξύ του θετικού άκρου ενός μορίου και του αρνητικού άκρου του άλλου.
ιονικοί δεσμοί περιλαμβάνουν τη μεταφορά ηλεκτρονίων μεταξύ των ατόμων και οδηγούν στο σχηματισμό ιόντων. ομοιοπολικοί δεσμοί περιλαμβάνουν την ανταλλαγή ηλεκτρονίων μεταξύ των ατόμων. Κανένας από αυτούς τους τύπους δεσμών δεν είναι υπεύθυνος για τη συγκράτηση των μορίων μαζί σε έναν κρύσταλλο.
Παράδειγμα:
Σε ένα κρύσταλλο πάγου (H2O), τα μόρια νερού συγκρατούνται μαζί με δεσμούς υδρογόνου. Οι ομοιοπολικοί δεσμοί μέσα σε κάθε μόριο νερού είναι ισχυροί, αλλά οι δεσμοί υδρογόνου μεταξύ των μορίων είναι αυτό που δίνει στον πάγο τη σταθερή δομή του.