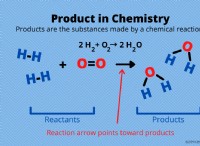
Γιατί μερικά πράγματα είναι πιο διαλυτά από άλλα;
Ακολουθεί μια ανάλυση των βασικών παραγόντων που επηρεάζουν τη διαλυτότητα:
1. Πολικότητα:
* πολικά μόρια: Έχουν ανομοιογενή κατανομή της πυκνότητας ηλεκτρονίων, δημιουργώντας μερικές θετικές και αρνητικές χρεώσεις (όπως το νερό). Διαλύονται καλά σε άλλους πολικούς διαλύτες.
* Μη πολικά μόρια: Έχετε ομοιόμορφη κατανομή ηλεκτρονίων, χωρίς σημαντικό διαχωρισμό φορτίου (όπως το πετρέλαιο). Διαλύονται καλά σε άλλους μη πολικούς διαλύτες.
* Οι πολικές και μη πολικές ουσίες γενικά δεν αναμειγνύονται καλά. Σκεφτείτε το νερό και το πετρέλαιο - χωρίζονται σε ξεχωριστά στρώματα επειδή οι πολικότητες τους συγκρούονται.
2. Διαμοριακές δυνάμεις:
* δεσμός υδρογόνου: Μια ισχυρή έλξη μεταξύ των ατόμων υδρογόνου και των εξαιρετικά ηλεκτροαρνητικών ατόμων (όπως το οξυγόνο ή το άζωτο). Διαδραματίζει σημαντικό ρόλο στη διαλυτότητα των πολικών μορίων.
* αλληλεπιδράσεις διπόλης-διπόλης: Αξιοθέατα μεταξύ του θετικού άκρου ενός πολικού μορίου και του αρνητικού άκρου του άλλου.
* Δυνάμεις διασποράς του Λονδίνου: Αδύναμα αξιοθέατα μεταξύ όλων των μορίων, ακόμη και των μη πολικών. Είναι οι μόνες δυνάμεις που υπάρχουν μεταξύ μη πολικών μορίων.
3. Θερμοκρασία:
* Η διαλυτότητα των στερεών και των υγρών γενικά αυξάνεται με τη θερμοκρασία. Η αυξημένη κινητική ενέργεια βοηθά στην αντιμετώπιση των δυνάμεων που συγκρατούν τη διαλυτή ουσία μαζί, επιτρέποντάς της να διαλύεται καλύτερα.
* Η διαλυτότητα των αερίων μειώνεται με τη θερμοκρασία. Αυτό οφείλεται στο γεγονός ότι τα αέρια είναι πιο διαλυτά σε χαμηλότερες θερμοκρασίες, όπου είναι πιο πιθανό να παραμείνουν διαλυμένα.
4. Πίεση:
* Η πίεση έχει σημαντική επίδραση στη διαλυτότητα των αερίων. Η αύξηση της πίεσης αναγκάζει περισσότερα μόρια αερίου σε διάλυμα. Αυτός είναι ο λόγος για τον οποίο τα ανθρακούχα ποτά σβήνουν όταν απελευθερωθεί η πίεση, επιτρέποντας στο διαλυμένο CO2 να δραπετεύσει.
5. Άλλοι παράγοντες:
* Μοριακό μέγεθος: Τα μικρότερα μόρια είναι γενικά πιο διαλυτά από τα μεγαλύτερα, καθώς μπορούν πιο εύκολα να αλληλεπιδρούν με τα μόρια του διαλύτη.
* Χημική δομή: Η συγκεκριμένη διάταξη των ατόμων και των λειτουργικών ομάδων σε ένα μόριο μπορεί να επηρεάσει τη διαλυτότητα του.
Συνοπτικά:
Η διαλυτότητα είναι ένα πολύπλοκο φαινόμενο, αλλά η κατανόηση των αρχών του "όπως διαλύεται όπως" και ο ρόλος των διαμοριακών δυνάμεων, της θερμοκρασίας και της πίεσης μπορούν να βοηθήσουν στην πρόβλεψη και στην εξήγηση της διαλυτότητας διαφορετικών ουσιών.