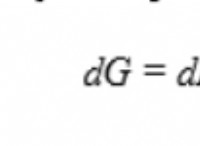Τι είναι οι αντιδράσεις περιορισμένης ισορροπίας;
Αντιδράσεις περιορισμένης ισορροπίας:Όταν τα προϊόντα μπορούν να μετατραπούν σε αντιδραστήρια
Μια αντίδραση με περιορισμένη ισορροπία είναι μια χημική αντίδραση όπου ο ρυθμός της αντίδρασης προς τα εμπρός (αντιδραστήρια στα προϊόντα) και ο ρυθμός της αντίστροφης αντίδρασης (προϊόντα σε αντιδραστήρια) καθίστανται ίσοι. Αυτό οδηγεί σε κατάσταση δυναμική ισορροπία , όπου οι συγκεντρώσεις των αντιδραστηρίων και των προϊόντων παραμένουν σταθερές με την πάροδο του χρόνου, παρόλο που η αντίδραση εξακολουθεί να συνεχίζεται.
Ακολουθεί μια κατανομή των βασικών σημείων:
1. Αναστρέψιμες αντιδράσεις: Οι αντιδράσεις περιορισμένης ισορροπίας είναι πάντα αναστρέψιμες , που σημαίνει ότι μπορούν να προχωρήσουν και στις δύο κατευθύνσεις. Αυτό είναι σε αντίθεση με τις μη αναστρέψιμες αντιδράσεις, οι οποίες προχωρούν μόνο προς μία κατεύθυνση.
2. Σταθερές συγκεντρώσεις: Σε ισορροπία, η καθαρή μεταβολή των συγκεντρώσεων των αντιδραστηρίων και των προϊόντων είναι μηδενική. Αυτό δεν σημαίνει ότι η αντίδραση έχει σταματήσει, αλλά μάλλον ότι οι εμπρόσθιες και αντίστροφες αντιδράσεις συμβαίνουν με τον ίδιο ρυθμό, με αποτέλεσμα τη συνολική αλλαγή.
3. Αρχή του Le Chatelier: Οι αλλαγές σε συνθήκες όπως η θερμοκρασία, η πίεση ή η συγκέντρωση μπορούν να μετατοπίσουν το σημείο ισορροπίας. Αυτό διέπεται από την αρχή του le Chatelier , η οποία δηλώνει ότι το σύστημα θα μετατοπιστεί προς μια κατεύθυνση που ανακουφίζει το άγχος. Για παράδειγμα, η αύξηση της συγκέντρωσης ενός αντιδραστηρίου θα ευνοήσει την αντίδραση προς τα εμπρός, μετατοπίζοντας την ισορροπία προς περισσότερα προϊόντα.
4. Σταθερά ισορροπίας (k): Η αναλογία των συγκεντρώσεων προϊόντων σε συγκεντρώσεις αντιδραστηρίου σε ισορροπία ονομάζεται σταθερά ισορροπίας (k) . Μια μεγάλη τιμή K δείχνει ότι η ισορροπία βρίσκεται πολύ προς τα δεξιά, πράγμα που σημαίνει ότι τα προϊόντα ευνοούνται. Μια μικρή τιμή K δείχνει ότι η ισορροπία βρίσκεται πολύ προς τα αριστερά, πράγμα που σημαίνει ότι τα αντιδραστήρια ευνοούνται.
Παραδείγματα αντιδράσεων περιορισμένης ισορροπίας:
* Η σύνθεση αμμωνίας: N2 (g) + 3Η2 (g) ⇌ 2NH3 (g)
* Η αντίδραση μεταξύ οξικού οξέος και νερού: CH3COOH (AQ) + H2O (L) ⇌ CH3COO- (AQ) + H3O + (AQ)
* Η διάλυση ενός φειδώ διαλυτό αλατιού: AGCL ⇌ ag + (aq) + cl- (aq)
Σημασία:
Η κατανόηση των αντιδράσεων περιορισμένης ισορροπίας είναι απαραίτητη σε διάφορους τομείς όπως:
* Χημική μηχανική: Βελτιστοποίηση συνθηκών αντίδρασης για τη μεγιστοποίηση της απόδοσης του προϊόντος.
* Περιβαλλοντική χημεία: Κατανόηση της τύχης των ρύπων στο περιβάλλον.
* βιοχημεία: Ανάλυση των ενζυμικών αντιδράσεων και του ρόλου τους στις βιολογικές διεργασίες.
Συνολικά, οι αντιδράσεις περιορισμένες ισορροπίες αποτελούν θεμελιώδη έννοια στη χημεία που μας βοηθά να κατανοήσουμε τη δυναμική των χημικών αντιδράσεων και να προβλέπουμε τη συμπεριφορά τους υπό διαφορετικές συνθήκες.