Ποιες είναι οι αρχές της θεωρίας σύγκρουσης;
1. Συχνότητα σύγκρουσης:
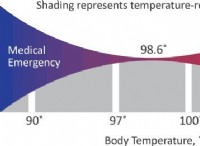
* Περισσότερες συγκρούσεις, περισσότερες αντιδράσεις: Τα πιο συχνά μόρια συγκρούονται, τόσο μεγαλύτερη είναι η πιθανότητα μιας αντίδρασης. Οι παράγοντες που επηρεάζουν τη συχνότητα σύγκρουσης περιλαμβάνουν συγκέντρωση, θερμοκρασία και επιφάνεια.
* Υψηλότερη συγκέντρωση =περισσότερες συγκρούσεις: Η αύξηση της συγκέντρωσης των αντιδραστηρίων σημαίνει ότι υπάρχουν περισσότερα μόρια σε έναν δεδομένο όγκο, οδηγώντας σε περισσότερες συγκρούσεις.
* υψηλότερη θερμοκρασία =ταχύτερα μόρια =περισσότερες συγκρούσεις: Καθώς αυξάνεται η θερμοκρασία, τα μόρια κινούνται ταχύτερα, οδηγώντας σε πιο συχνές και ενεργητικές συγκρούσεις.
* μεγαλύτερη επιφάνεια =περισσότερες συγκρούσεις: Για αντιδράσεις που περιλαμβάνουν στερεά, η αύξηση της επιφάνειας επιτρέπει περισσότερα σημεία επαφής και επομένως περισσότερες συγκρούσεις.
2. Ενέργεια ενεργοποίησης:
* Ενεργειακό φράγμα: Για να συμβεί μια αντίδραση, τα μόρια πρέπει να διαθέτουν ελάχιστη ποσότητα ενέργειας που ονομάζεται ενέργεια ενεργοποίησης. Αυτή η ενέργεια απαιτείται για να σπάσει τους υπάρχοντες δεσμούς και να ξεκινήσει η αντίδραση.
* υπέρβαση του φραγμού: Οι συγκρούσεις με ενέργεια μεγαλύτερη ή ίση με την ενέργεια ενεργοποίησης ονομάζονται αποτελεσματικές συγκρούσεις. Μόνο οι αποτελεσματικές συγκρούσεις οδηγούν σε σχηματισμό προϊόντων.
* Ενέργεια θερμοκρασίας και ενεργοποίησης: Η αύξηση της θερμοκρασίας παρέχει περισσότερα μόρια με επαρκή ενέργεια για να ξεπεραστεί ο ενεργειακός φραγμός ενεργοποίησης, οδηγώντας σε ταχύτερες αντιδράσεις.
3. Ο σωστός προσανατολισμός:
* Η σωστή ευθυγράμμιση έχει σημασία: Ακόμη και αν τα μόρια έχουν αρκετή ενέργεια, πρέπει να συγκρουστούν με τον σωστό προσανατολισμό για να συμβεί μια αντίδραση. Αυτό σημαίνει ότι τα αντιδραστικά μέρη των μορίων πρέπει να έρθουν σε επαφή.
* Προσανατολισμός και πιθανότητα: Η πιθανότητα μιας επιτυχημένης σύγκρουσης με τον σωστό προσανατολισμό είναι συχνά χαμηλή, συμβάλλοντας στο συνολικό ρυθμό αντίδρασης.
Συνοπτικά, η θεωρία σύγκρουσης δηλώνει ότι:
* Οι αντιδράσεις συμβαίνουν λόγω συγκρούσεων μεταξύ μορίων αντιδραστηρίου.
* Όλες οι συγκρούσεις δεν είναι αποτελεσματικές. Οι αποτελεσματικές συγκρούσεις απαιτούν αρκετή ενέργεια και κατάλληλο προσανατολισμό.
* Ο ρυθμός αντίδρασης καθορίζεται από τη συχνότητα των αποτελεσματικών συγκρούσεων.
Εφαρμογές της θεωρίας σύγκρουσης:
* Κατανόηση των ρυθμών αντίδρασης: Η θεωρία σύγκρουσης βοηθά να εξηγηθεί γιατί ορισμένοι παράγοντες (συγκέντρωση, θερμοκρασία, επιφάνεια) επηρεάζουν τους ρυθμούς αντίδρασης.
* Σχεδιασμός καταλύτες: Οι καταλύτες μειώνουν την ενέργεια ενεργοποίησης, αυξάνοντας τη συχνότητα των αποτελεσματικών συγκρούσεων και την επιτάχυνση των αντιδράσεων.
* Πρόβλεψη αποτελεσμάτων αντίδρασης: Με την ανάλυση της δομής των μορίων και της ενέργειας ενεργοποίησης, μπορούμε να προβλέψουμε την πιθανότητα εμφάνισης αντίδρασης.
Η θεωρία σύγκρουσης είναι μια θεμελιώδη έννοια στη χημεία, παρέχοντας ένα πλαίσιο για την κατανόηση του τρόπου με τον οποίο συμβαίνουν οι αντιδράσεις και πώς μπορούν να επηρεαστούν.