Ποια είναι τα δύο σπάνια αμινοξέα;
Η σεληνοκυστεΐνη (Sec) και η πυρρολυσίνη (Pyl) είναι σπάνια αμινοξέα που δεν απαντώνται τόσο ευρέως όσο τα 20 κανονικά αμινοξέα.
Οι περισσότεροι άνθρωποι γνωρίζουν καλά ότι υπάρχουν 20 αμινοξέα που δημιουργούν τις πρωτεΐνες μας, αλλά τι θα γινόταν αν σας έλεγα ότι ήταν όντως λάθος, και στην πραγματικότητα, υπάρχουν μερικά επιπλέον αμινοξέα για τα οποία σπάνια μιλάμε;
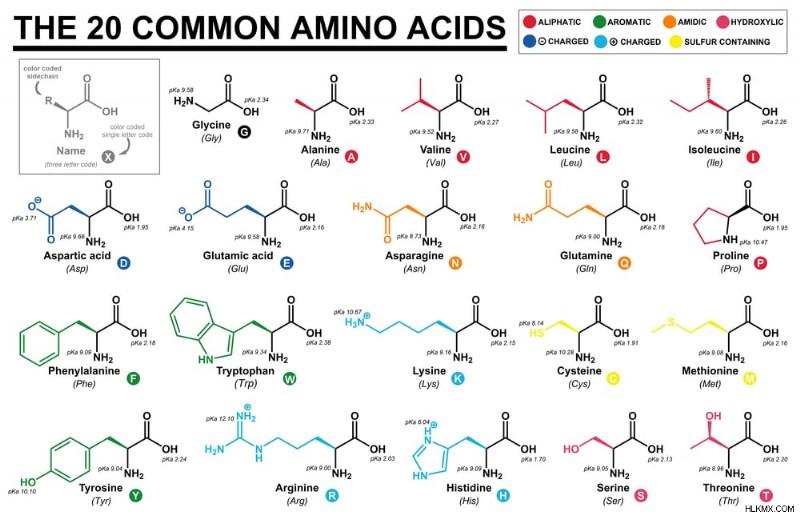
Τα κοινά αμινοξέα (Φωτογραφία:Cristian Victor Rete/Shutterstock)
Συνολικά 22 αμινοξέα έχουν οριστεί στο DNA μας. Η σεληνοκυστεΐνη (Sec) και η πυρρολυσίνη (Pyl) είναι το 21ο και το 22ο αμινοξέα, αντίστοιχα. Αναφέρονται ως σπάνια αμινοξέα, καθώς δεν είναι τόσο διαδεδομένα στη φύση όσο τα υπόλοιπα αμινοξέα.
Γιατί ήταν τόσο συγκλονιστικό αυτό το εύρημα;
Τέσσερις νουκλεοτιδικές βάσεις, που συμβολίζονται με τα γράμματα A, G, T και C, αποτελούν το σύνολο του DNA μας. Όταν ανακαλύφθηκε ο γενετικός κώδικας στη δεκαετία του 1960, οι επιστήμονες διαπίστωσαν ότι διαβάζονταν με 3 γράμματα τη φορά. Αυτά τα τρία γράμματα είναι συλλογικά γνωστά ως κωδικόνια και υπάρχουν στο αγγελιοφόρο RNA (mRNA).
Κάθε κωδικόνιο θεωρήθηκε ότι έχει μια ενιαία λειτουργία:είτε υποδηλώνει ένα από τα 20 αμινοξέα είτε υποδηλώνει την αρχή (μέσω κωδικονίου έναρξης) ή το τελικό σημείο (μέσω του κωδικονίου λήξης) του μηχανισμού μετάφρασης που παράγει πρωτεΐνες.
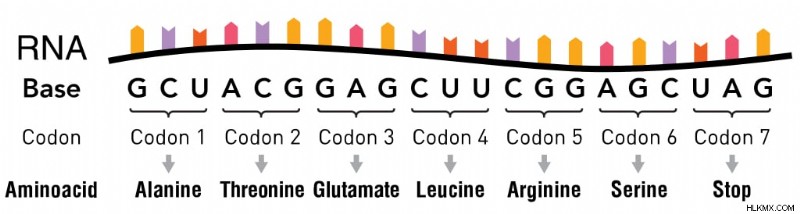
Κωδόνια σε mRNA που καθορίζουν ένα αμινοξύ και τερματίζουν σε ένα κωδικόνιο λήξης (Πιστωτική φωτογραφία :Thomas Splettstoesser/Wikimedia Commons)
Αν και αυτά τα 20 αμινοξέα είναι η ραχοκοκαλιά κάθε πρωτεΐνης, ορισμένες πρωτεΐνες έχουν διαφορετικά ή μη παραδοσιακά αμινοξέα. Τα περισσότερα από αυτά τα αμινοξέα, βρήκαν οι επιστήμονες, προήλθαν από τα αρχικά 20 των οποίων η δομή είχε αλλάξει μετά το σχηματισμό της πολυπεπτιδικής αλυσίδας στο τέλος της μετάφρασης. Αυτές οι αλλαγές είναι γνωστές ως μεταμεταφραστικές τροποποιήσεις και είναι απαραίτητα για να δώσουν στην πρωτεΐνη την απαραίτητη λειτουργία της.
Παρόλο που αυτά τα αμινοξέα είναι ασυνήθιστα, εξακολουθούν να έχουν σημαντικές λειτουργίες. Για παράδειγμα, η 4-υδροξυλυσίνη και η 5-υδροξυπρολίνη είναι παράγωγα της λυσίνης και της προλίνης, αντίστοιχα, και βρίσκονται στο κολλαγόνο (μια πρωτεΐνη που βρίσκεται στον συνδετικό ιστό).
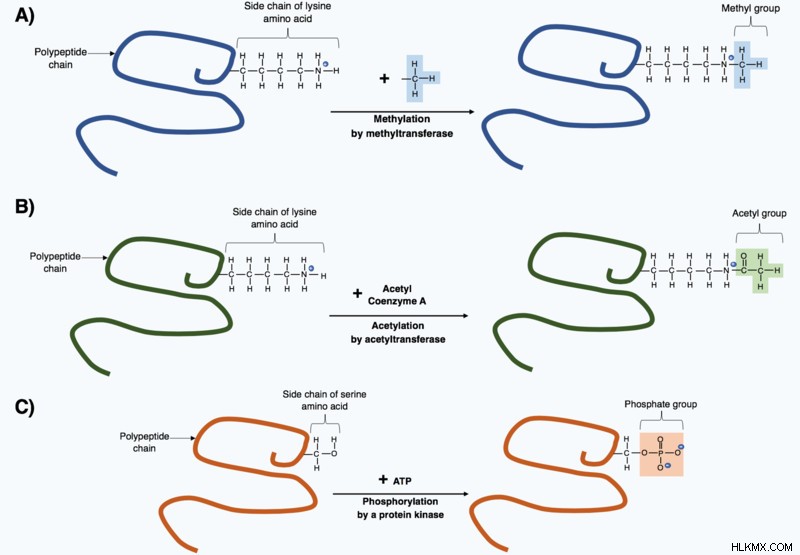
Τροποποιήσεις μετά τη μετάφραση (Πιστωτική φωτογραφία :Kep17/Wikimedia Commons)
Επομένως, όταν η σεληνοκυστεΐνη (Sec) και η πυρρολυσίνη (Pyl) ανακαλύφθηκαν για πρώτη φορά σε πρωτεΐνες, θεωρήθηκε ότι προκύπτουν από τέτοιες μετα-μεταφραστικές τροποποιήσεις στην κυστεΐνη και τη λυσίνη, αντίστοιχα. Ωστόσο, το 1986, δύο σημαντικές ανακαλύψεις αποκάλυψαν ότι η σεληνοκυστεΐνη κωδικοποιήθηκε στην πραγματικότητα από το κωδικόνιο λήξης UGA. 16 χρόνια αργότερα, η πυρρολυσίνη αναγνωρίστηκε ότι κωδικοποιείται από το κωδικόνιο τερματισμού UAG!
Μέχρι τα μέσα της δεκαετίας του 1960, ήταν πολύ γνωστό ότι το κωδικόνιο έναρξης (AUG) κωδικοποιούσε το αμινοξύ μεθειονίνη, αλλά τα κωδικόνια λήξης (UAG, UAA και UGA) δεν πίστευαν ότι κωδικοποιούσαν καμία πρωτεΐνη, αλλά απλώς τερματίζουν τη μετάφραση. Στην πραγματικότητα, έχουν αναφερθεί ακόμη και ως ανόητα κωδικόνια, αφού δεν σχηματίζουν αμινοξέα.
Επομένως, αυτή η ανακάλυψη ήταν πρωτοποριακή, καθώς απέδωσε νέο ρόλο στα κωδικόνια στοπ. Επιπλέον, οι δύο ανακαλύψεις έγιναν χωριστά, σε δύο διακριτούς οργανισμούς—E. coli και ποντίκια—δείχνοντας ότι τέτοια ασυνήθιστα αμινοξέα υπήρχαν σε μια μεγάλη ποικιλία ειδών.
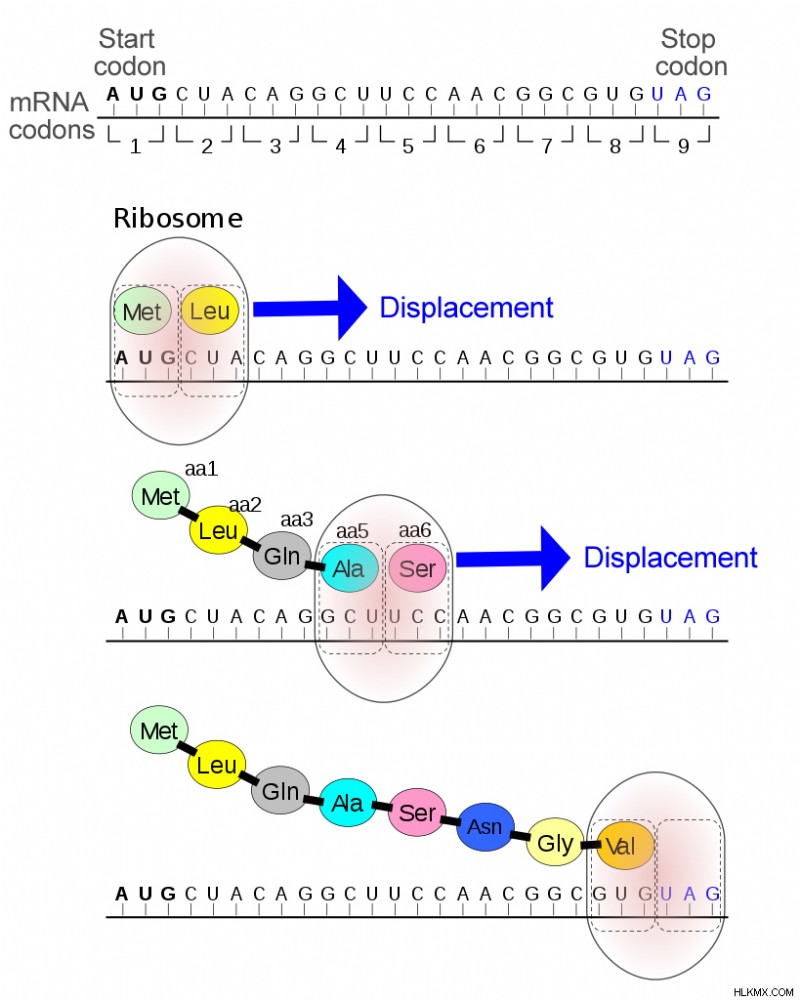
Συνήθης μηχανισμός ενός κωδικονίου διακοπής (Φωτογραφία :Alain Gallien/Wikimedia Commons)
16 χρόνια αργότερα, η πυρρολυσίνη αναγνωρίστηκε ως κωδικοποιούμενη από το κωδικόνιο λήξης UAG!
Γιατί είναι σπάνια;
Παρόλο που η Σεληνοκυστεΐνη (Sec) και η Πυρρολυσίνη (Pyl) κωδικοποιούνται στο DNA, σε αντίθεση με τα τυπικά αμινοξέα, απαιτούν έναν ειδικό μηχανισμό για να ενσωματωθούν σε μια πρωτεΐνη. Στην πραγματικότητα, απαιτούν δύο μηχανισμούς, γιατί παρόλο που αυτά τα δύο σπάνια αμινοξέα κωδικοποιούνται και τα δύο από κωδικόνια λήξης, το κάνουν χρησιμοποιώντας εντελώς διαφορετικούς μηχανισμούς.
Η παρουσία της πυρρολυσίνης περιορίζεται σε ένα μικρό ποσοστό πρωτεϊνών σε πολύ περιορισμένο αριθμό οργανισμών. Μέχρι στιγμής, μόνο 11 οργανισμοί από τους περίπου 1.000 οργανισμούς για τους οποίους είναι διαθέσιμα πλήρη γονιδιωματικά δεδομένα κωδικοποιούν την πυρρολυσίνη.
Από την άλλη πλευρά, η σεληνοκυστεΐνη είναι παρούσα σε μια πληθώρα οργανισμών και στους τρεις τομείς (Αρχαία, Βακτήρια, Ευκαρία) της ζωής. Πιστεύεται ότι συντίθεται από σχεδόν το ένα τέταρτο των βακτηρίων που έχουν προσδιοριστεί σε αλληλουχία. Ωστόσο, είναι ενδιαφέρον ότι μόλις 17 πρωτεΐνες θηλαστικών έχουν βρεθεί ότι συνθέτουν σεληνοκυστεΐνη.
Είναι σημαντικά;
Οι επιστήμονες γνώριζαν ήδη ότι, παρόλο που πολλά μη τυποποιημένα αμινοξέα μπορεί να μην ενσωματώνονται στις πρωτεΐνες, εξακολουθούν να είναι κρίσιμα ενδιάμεσα σε πολυάριθμες μεταβολικές διεργασίες. Δεδομένου ότι η σεληνοκυστεΐνη και η πυρρολυσίνη κωδικοποιούνται στην πραγματικότητα από το DNA, ήταν ακόμη πιο πιθανό να είναι απαραίτητες. Ωστόσο, λόγω της σπανιότητάς τους, η σημασία αυτών των δύο αμινοξέων έχει αγνοηθεί μέχρι πρόσφατα.
Η σεληνοκυστεΐνη είναι δομικά παρόμοια με την κυστεΐνη και περιέχει ένα απαραίτητο μικροθρεπτικό συστατικό - σελήνιο - στη θέση του ατόμου θείου που βρίσκεται στην κυστεΐνη. Είναι ένα κρίσιμο αμινοξύ που βρίσκεται στις σεληνοπρωτεΐνες και σχετίζεται με μια σειρά μεταβολικών και κυτταρικών διεργασιών. Ένα έλλειμμα σεληνίου στον εγκέφαλο έχει βρεθεί ότι προκαλεί νευρολογικές ανωμαλίες όπως επιληπτικές κρίσεις. Έχει συνδεθεί με μια σειρά από άλλες ασθένειες, εκτός από τις νευροεκφυλιστικές διαταραχές. Ωστόσο, οι ερευνητές δεν έχουν ακόμη εντοπίσει τον ακριβή ρόλο του στον μηχανισμό της νόσου.

Δομή της σεληνοκυστεΐνης (Φωτογραφία :Shmitt Maria/Shutterstock)
Η πυρρολυσίνη εντοπίστηκε σε ένα μεθανογόνο, Methanosarcina barkeri , που μπορεί να βρεθεί στο στομάχι των αγελάδων! Μέχρι πρόσφατα, πρωτεΐνες που περιέχουν πυρρολυσίνη βρίσκονταν μόνο σε μεθανογόνα, υπονοώντας ότι παίζει ρόλο στην παραγωγή μεθανίου (μεθανογένεση). Είναι δομικά παρόμοιο με τη λυσίνη και βοηθά το ένζυμο μεθυλοτρανσφεράση κατά τη διάρκεια της μεθανογένεσης. Απαιτούνται περαιτέρω μελέτες για να προσδιοριστεί εάν η πυρρολυσίνη παίζει ρόλο σε άλλες διεργασίες.
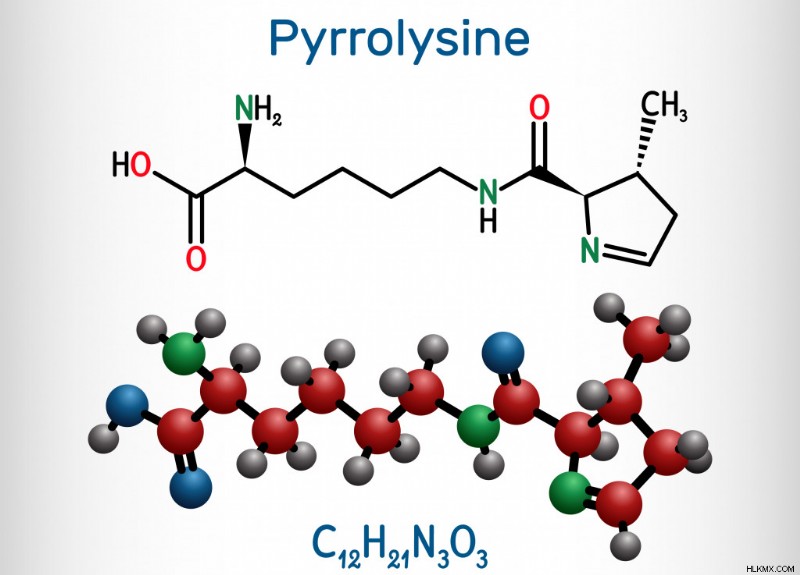
Δομή της πυρρολυσίνης (Φωτογραφία :Bacsica/Shutterstock)
Συμπέρασμα
Το γιατί και πότε κατά την εξέλιξη της ζωής αυτά τα δύο αμινοξέα προστέθηκαν στο γονιδίωμα λίγων οργανισμών παραμένει ένα μυστήριο. Ενώ επί του παρόντος κατηγοριοποιούνται ως σπάνια, περαιτέρω έρευνα μπορεί να μας αποδείξει ότι κάνουμε λάθος. Εξάλλου, σύμφωνα με τα λόγια του Άλμπερτ Αϊνστάιν, «Δεν γνωρίζουμε ακόμη το ένα χιλιοστό του ενός τοις εκατό αυτού που μας έχει αποκαλύψει η φύση».




