Διαφορά μεταξύ άλφα και βήτα αμυλάσης
Κύρια διαφορά – Άλφα έναντι βήτα αμυλάσης
Η δράση του ενζύμου αμυλάσης μπορεί να υδρολύσει το άμυλο σε μονάδες σακχάρου. Η αμυλάση είναι φυσικά παρούσα στο σάλιο και το πάγκρεας των ανθρώπων και ορισμένων άλλων θηλαστικών, όπου ξεκινά τη βιοχημική διαδικασία της πέψης βλωμού των τροφών. Κατά τη διάρκεια της στοματικής πέψης, οι αμυλώδεις τροφές (ρύζι, ψωμί, γιαμ και πατάτες), δίνουν μια κάπως γλυκιά γεύση επειδή η αμυλάση του σάλιου αποικοδομεί μέρος του αμύλου τους σε ζάχαρη. Η αμυλάση ανακαλύφθηκε και απομονώθηκε για πρώτη φορά από τον Anselme Payen το 1833. Τα ένζυμα αμυλάσης ονομάζονται συγκεκριμένα με διαφορετικά ελληνικά γράμματα, συμπεριλαμβανομένων των άλφα (α)-αμυλάση, βήτα (β)-αμυλάση και γάμμα (γ)-αμυλάση. Όλα αυτά τα ένζυμα είναι γλυκοσιδικές υδρολάσες και δρουν στους α-1,4-γλυκοσιδικούς δεσμούς. Η Η άλφα (α)-αμυλάση θεωρείται ότι είναι ένα κύριο πεπτικό ένζυμο, ενώ η βήτα (β)-αμυλάση θεωρείται ότι είναι ένα κύριο ένζυμο που εμπλέκεται στη βλάστηση των σπόρων και στην ωρίμανση των καρπών. Αλλά σε σύγκριση με τη βήτα (β)-αμυλάση και γάμμα (γ)-αμυλάση, οι α-αμυλάσες (EC 3.2.1.1) είναι μεταλλοένζυμα ασβεστίου και δεν μπορούν να λειτουργήσουν απουσία ασβεστίου. Αυτή είναι η κύρια διαφορά μεταξύ άλφα και βήτα αμυλάσης. Ωστόσο, τόσο οι άλφα όσο και οι βήτα αμυλάσες χρησιμοποιούνται εμπορικά σε διεργασίες ζύμωσης όπως η παρασκευή μπύρας και οινοπνευματωδών ποτών που παρασκευάζονται από σάκχαρα που προέρχονται από άμυλο. Σε αυτό το άρθρο, ας επεξεργαστούμε περαιτέρω ποιες είναι οι διαφορές μεταξύ της Άλφα και της Βήτα Αμυλάσης.
Αυτό το άρθρο καλύπτει,
1. Τι είναι η Alpha Amylase; – Ορισμός, Λειτουργίες, Ιδιότητες και Χαρακτηριστικά
2. Τι είναι η βήτα αμυλάση; – Ορισμός, Λειτουργίες, Ιδιότητες και Χαρακτηριστικά
3. Ποια είναι η διαφορά μεταξύ της Άλφα και της Βήτα Αμυλάσης; – Σύγκριση φυσικών και λειτουργικών χαρακτηριστικών

Τι είναι η άλφα αμυλάση
Η άλφα αμυλάση θεωρείται ως κύριο πεπτικό ένζυμο στην πεπτική οδό των θηλαστικών. Οι αμυλάσες του ανθρώπινου σάλιου και του παγκρέατος είναι α-αμυλάσες και φυτά, μύκητες (ασκομύκητες και βασιδιομύκητες ) και βακτήρια (Βάκιλλος ) μπορεί επίσης να παράγει α-αμυλάσες.
Το βέλτιστο pH της άλφα αμυλάσης είναι 6,7–7,0. Το ασβέστιο είναι απαραίτητο για τη λειτουργία των α-αμυλασών. ως εκ τούτου είναι γνωστό ως μεταλλοένζυμο ασβεστίου. Η άλφα αμυλάση μπορεί να διασπάσει υδατάνθρακες μακράς αλυσίδας, όπως αμυλόζη αμύλου σε μαλτοτριόζη και μαλτόζη ή αμυλοπηκτίνη σε μαλτόζη, γλυκόζη και οριακή δεξτρίνη.
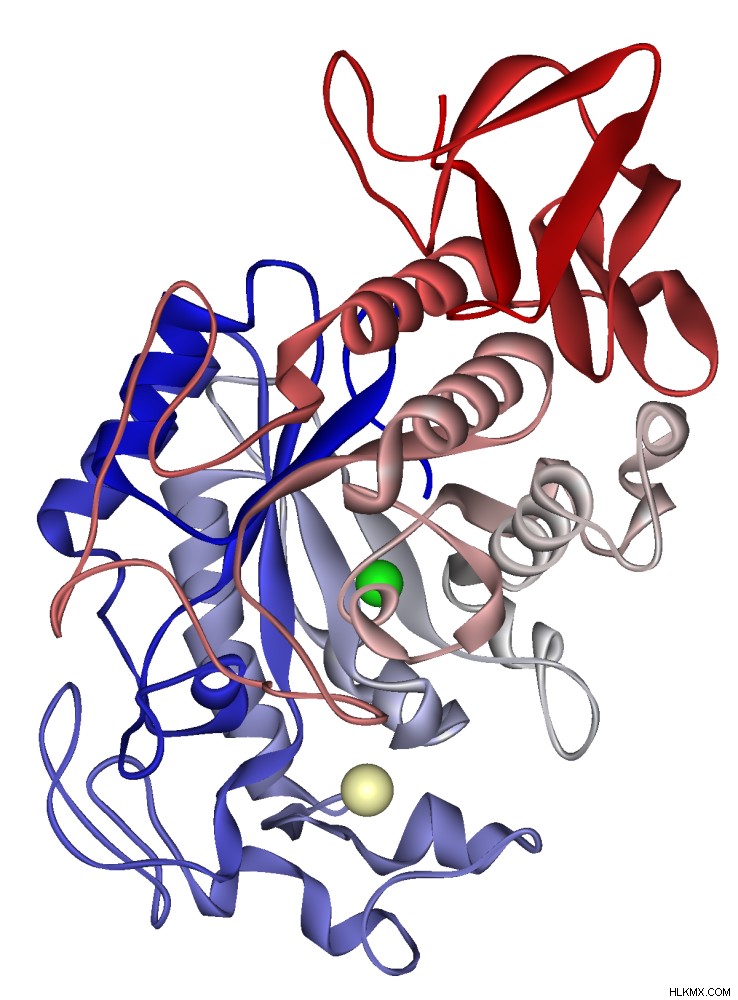
Διάγραμμα κορδέλας άλφα-αμυλάσης ανθρώπινου σάλιου
Τι είναι η βήτα αμυλάση
Η βήτα αμυλάση παράγεται κυρίως από βακτήρια, μύκητες και φυτά και καταλύει την ενζυματική διάσπαση του δεύτερου α-1,4 γλυκοσιδικού δεσμού των μη αναγωγικών σακχάρων, με αποτέλεσμα να διασπάται μαλτόζη κάθε φορά. Η β-αμυλάση διασπά το άμυλο σε μαλτόζη, προκαλώντας τη γλυκιά γεύση των ώριμων φρούτων. Το βέλτιστο pH για τη λειτουργία της β-αμυλάσης είναι 4,0–5,0. Τα ζώα δεν παράγουν β-αμυλάση.
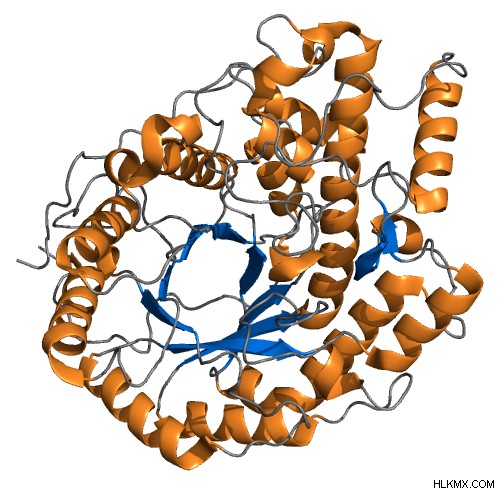
Διάγραμμα κορδέλας βήτα-αμυλάσης κριθαριού
Διαφορά μεταξύ άλφα και βήτα αμυλάσης
Η άλφα και η βήτα αμυλάση έχουν σημαντικά διαφορετικά φυσικά και λειτουργικά χαρακτηριστικά. Αυτά μπορούν να κατηγοριοποιηθούν στις ακόλουθες υποομάδες,
Εναλλακτικά ονόματα
Άλφα αμυλάση: Η γλυκανοϋδρολάση της 1,4-α-D-γλυκάνης και η γλυκογονάση είναι εναλλακτικές ονομασίες για την α-αμυλάση.
Βήτα αμυλάση: Η 1,4-α-D-γλυκάνη μαλτοϋδρολάση, η γλυκογονάση και η σακχαρογόνο αμυλάση είναι εναλλακτικές ονομασίες για τη β-αμυλάση.
Αριθμός ΕΚ
Άλφα αμυλάση: EC 3.2.1.1
Βήτα αμυλάση: EC 3.2.1.2
Παραγωγή
Άλφα αμυλάση: Το πεπτικό σύστημα των θηλαστικών μπορεί να συνθέσει α-αμυλάση. Έτσι οι ανθρώπινες αμυλάσες του σάλιου και του παγκρέατος είναι α-αμυλάσες. Επιπλέον, α– Οι αμυλάσες μπορούν να παραχθούν από φυτά, μύκητες (ασκομύκητες και βασιδιομύκητες) και βακτήρια (Bacillus).
Βήτα αμυλάση: Η β-αμυλάση παράγεται από βακτήρια, μύκητες και φυτά. Οι ιστοί ή τα κύτταρα του ζώου δεν μπορούν να παράγουν β-αμυλάση, παρόλο που μπορεί να υπάρχει σε μικροοργανισμούς που υπάρχουν στην πεπτική οδό.
Ο ρόλος του ασβεστίου
Άλφα αμυλάση: Το ασβέστιο είναι απαραίτητο για τη λειτουργία των α-αμυλασών και ως εκ τούτου είναι γνωστό ως μεταλλοένζυμο ασβεστίου.
Βήτα αμυλάση: Το ασβέστιο δεν απαιτείται για τη λειτουργία των β-αμυλασών.
Βέλτιστο pH
Άλφα αμυλάση: Το βέλτιστο pH για τη β-αμυλάση είναι 6,7–7,0
Βήτα αμυλάση: Το βέλτιστο pH για τη β-αμυλάση είναι 4,0–5,0
Κύρια συνάρτηση
Άλφα αμυλάση: Η α-αμυλάση εμπλέκεται κυρίως στη διαδικασία πέψης των τροφών.
Βήτα αμυλάση: Η β-αμυλάση εμπλέκεται κυρίως στη διαδικασία ωρίμανσης και βλάστησης των σπόρων.
Ιστότοπος δράσης
Άλφα αμυλάση: Η α-αμυλάση μπορεί να δράσει οπουδήποτε στο υπόστρωμα.
Βήτα αμυλάση: Η β-αμυλάση μπορεί να δράσει από το μη αναγωγικό άκρο και καταλύει την υδρόλυση του δεύτερου α-1,4 γλυκοσιδικού δεσμού
Κύρια αποτελέσματα των ενζυματικών αντιδράσεων
Alpha Αμυλάση: Οι υδατάνθρακες μακράς αλυσίδας (κλώνοι αμυλόζης και αμυλοπηκτίνης) μπορούν να διασπαστούν από την α-αμυλάση και να δώσουν μαλτοτριόζη και μαλτόζη από αμυλόζη ή μαλτόζη, γλυκόζη και οριακή δεξτρίνη από αμυλοπηκτίνη
Βήτα αμυλάση: Κατά τη διαδικασία ωρίμανσης των φρούτων, το άμυλο διασπάται από τη β-αμυλάση σε μαλτόζη, προκαλώντας τη γλυκιά γεύση των ώριμων φρούτων.
Ρυθμός αντίδρασης
Άλφα αμυλάση: Η α-αμυλάση έχει την τάση να έχει ταχύτερη δράση από τη β-αμυλάση.
Βήτα αμυλάση: Η β-αμυλάση έχει την τάση να έχει βραδύτερη δράση από την α-αμυλάση.
Φυσικές και χημικές ιδιότητες
Alpha Αμυλάση: Η α-αμυλάση δεν είναι ευαίσθητη σε υψηλές θερμοκρασίες και ιόντα βαρέων μετάλλων και αδρανοποιείται σε χαμηλό pH.
Βήτα αμυλάση: Η β-αμυλάση είναι ευαίσθητη σε υψηλές θερμοκρασίες και ιόντα βαρέων μετάλλων και είναι σταθερή σε χαμηλό pH.
Συμπερασματικά, η αμυλάση είναι ένα ένζυμο που μπορεί να υδρολύσει το άμυλο σε μικρότερα μόρια. Αλλά η α-αμυλάση απαιτεί Ca για δραστηριότητα και αποδίδει γλυκόζη, μαλτοτριόζη και μαλτόζη ως τελικά προϊόντα. Αντίθετα, η β-αμυλάση δεν απαιτεί Ca και υδρολύει το διαλυτό άμυλο ή την αμυλόζη, αποδίδοντας μόνο μαλτόζη ως τελικό προϊόν.
Αναφορές
Frydenberg, O και G. Nielsen. 1965. Ισόζυμα αμυλάσης σε σπόρους κριθαριού που βλασταίνουν. Hereditas 54:123-129.
Onckelen, H. A. και R. Verbeek. 1969. Σχηματισμός ισοενζύμων α-αμυλάσης κατά τη βλάστηση του κριθαριού. Planta 88:255-260.
Rejzek, M.; Stevenson, C. Ε.; Southard, Α. Μ.; Stanley, D.; Denyer, Κ.; Smith, Α. Μ.; Naldrett, Μ. J.; Lawson, D. M.; Field, R. A. (2011). «Χημική γενετική και μεταβολισμός αμύλου δημητριακών:Δομική βάση της μη ομοιοπολικής και ομοιοπολικής αναστολής της β-αμυλάσης κριθαριού». Molecular BioSystems. 7 (3):718–730.




