Lewis Dot Structures
Βασικές έννοιες
Σε αυτό το σεμινάριο, θα μάθετε πώς να σχεδιάζετε τις σωστές δομές κουκκίδων lewis για στοιχεία και ενώσεις. Επιπλέον, θα μάθετε για τα ηλεκτρόνια σθένους και τον κανόνα της οκτάδας.
Θέματα που καλύπτονται σε άλλα άρθρα
- Πολυατομικά ιόντα
- Ηλεκτρόνια
- Περιοδικές τάσεις
- Δομές συντονισμού
Λεξιλόγιο
- Ηλεκτρόνια σθένους:Ηλεκτρόνια στο εξώτατο κέλυφος ενός ατόμου.
- Κανόνας οκτάδας:Τα στοιχεία προτιμούν να έχουν 8 ηλεκτρόνια σθένους και θα συνδέονται ανάλογα.
- Αριθμοί ομάδας:Οι αριθμοί που εκτείνονται κατά μήκος της κορυφής του περιοδικού και περιέχουν άτομα με την ίδια χημική αντιδραστικότητα.
Τι είναι οι δομές lewis;
Το 1916, ο Αμερικανός χημικός, Gilbert N. Lewis, εισήγαγε γραμμές δεσμού στις δομές ηλεκτρονικών κουκίδων. Αυτές οι δομές, επίσης γνωστές ως δομές lewis ή δομές ηλεκτρονικών κουκκίδων, είναι σχέδια που δείχνουν οπτικά πώς τα ηλεκτρόνια μοιράζονται και διατάσσονται γύρω από τα άτομα. Τα ηλεκτρόνια που συμβολίζονται ως τελείες ονομάζονται μοναχικά ζεύγη και ανήκουν σε ένα μεμονωμένο άτομο. Τα ηλεκτρόνια που συμβολίζονται ως γραμμές είναι δεσμοί και δείχνουν την κοινή χρήση δύο ηλεκτρονίων μεταξύ δύο ατόμων.
Πώς να δημιουργήσετε μια δομή κουκκίδων lewis
1. Βρείτε τον συνολικό αριθμό ηλεκτρονίων σθένους.
Για να σχεδιάσετε τη δομή lewis, θα χρειαστεί να γνωρίζετε τον συνολικό αριθμό ηλεκτρονίων σθένους που υπάρχουν. Ο αριθμός των ηλεκτρονίων σθένους σε ένα μεμονωμένο άτομο μπορεί να βρεθεί με βάση τον αριθμό της ομάδας του ατόμου στον περιοδικό πίνακα. Παρακάτω είναι ένας πίνακας που συντονίζει τον αριθμό της ομάδας με τα ηλεκτρόνια σθένους. Οι ομάδες 3-12, που είναι τα μέταλλα μετάπτωσης, θα έχουν μόνο δύο ηλεκτρόνια σθένους λόγω του ότι το τροχιακό κέλυφος 4s πληρούται. Η ομάδα 18, που είναι τα ευγενή αέρια, θα έχει μια πλήρη οκτάδα.
| Αριθμός ομάδας | 1 | 2 | 3-12 | 13 | 14 | 15 | 16 | 17 | 18 |
| Αριθμός ηλεκτρονίων σθένους | 1 | 2 | 2 | 3 | 4 | 5 | 6 | 7 | 8 |
Εάν σχεδιάζετε τη δομή lewis για περισσότερα από ένα άτομα, θα πρέπει να τα αθροίσετε. Για παράδειγμα:
- O3 =6×3=18
- Το οξυγόνο συνεισφέρει 6 ηλεκτρόνια σθένους ανά άτομο. Εφόσον υπάρχουν τρία άτομα οξυγόνου, υπάρχουν 18 ηλεκτρόνια σθένους.
- NaCl =1+7=8
- Το νάτριο συνεισφέρει 1 ηλεκτρόνιο.
- Το χλώριο συνεισφέρει 7 ηλεκτρόνια.
- NH4 =5+ (1×4)- (1)
- Το άζωτο συνεισφέρει 5 ηλεκτρόνια σθένους.
- Το υδρογόνο συνεισφέρει 4 ηλεκτρόνια σθένους επειδή υπάρχουν 4 άτομα και το καθένα δίνει 1 ηλεκτρόνιο.
- Τέλος, εφόσον υπάρχει θετικό φορτίο, θα αφαιρέσουμε 1 ηλεκτρόνιο σθένους. Αν ήταν αρνητικό, θα προσθέταμε 1.
2. Προσδιορίστε το κεντρικό άτομο
Μόλις μάθετε τον αριθμό των ηλεκτρονίων σθένους που υπάρχουν, θα πρέπει τώρα να προσδιορίσετε το κεντρικό άτομο. Το κεντρικό άτομο έχει μερικά βασικά χαρακτηριστικά. Πρώτον, είναι το άτομο που μπορεί να κάνει τους περισσότερους δεσμούς και επομένως είναι ιδανικό για να βρίσκεται στο κέντρο. . Τυπικά, είναι επίσης το άτομο από το οποίο υπάρχει μόνο ένα και είναι το λιγότερο ηλεκτραρνητικό άτομο. Μπορείτε να βρείτε την περιοδική τάση για ηλεκτραρνητικότητα εδώ. Ποτέ δεν θα έβλεπε κανείς το φθόριο ως το κεντρικό άτομο.
3. Σχηματίστε απλούς δεσμούς μεταξύ των ατόμων και στη συνέχεια τοποθετήστε τα υπόλοιπα ηλεκτρόνια στα άτομα ως μόνα ζεύγη.
Μόλις γνωρίζουμε τον αριθμό των ηλεκτρονίων σθένους που υπάρχουν, καθώς και τη θέση των ατόμων σε σχέση με τα άλλα, μπορούμε να αρχίσουμε να σχηματίζουμε απλούς δεσμούς. Αφού κάθε άτομο έχει έναν μόνο δεσμό, θα τοποθετήσουμε τον υπόλοιπο αριθμό ηλεκτρονίων σθένους στα άτομα. Θυμηθείτε ότι κάθε τελεία είναι ένα ηλεκτρόνιο και κάθε γραμμή αντιπροσωπεύει δύο ηλεκτρόνια. Είναι ζωτικής σημασίας να αντλήσουμε τον σωστό αριθμό ηλεκτρονίων. Για να βεβαιωθείτε ότι έχετε τη σωστή ποσότητα, μετρήστε τον αριθμό των ηλεκτρονίων που αντλήθηκαν και συγκρίνετε τον με τα συνολικά ηλεκτρόνια σθένους που υπολογίστηκαν προηγουμένως.
4. Μετακινήστε τα ηλεκτρόνια για να τηρήσετε τον κανόνα της οκτάδας.
Τώρα που έχουμε τον σωστό αριθμό ηλεκτρονίων τοποθετημένα στα άτομα, θα τα μετακινήσουμε για να σχηματίσουν διπλούς ή τριπλούς δεσμούς. Αυτό γίνεται επειδή κάθε άτομο θέλει να έχει το κέλυφος σθένους του γεμάτο με οκτώ ηλεκτρόνια. Αυτό ονομάζεται κανόνας οκτάδας. Επιπλέον, ορισμένα άτομα έχουν έναν καθορισμένο αριθμό δεσμών που τους αρέσει να σχηματίζουν. Ακολουθεί ένας πίνακας που το δείχνει.
| Atom | Άνθρακας | Άζωτο | Οξυγόνο | Φλεύρι |
| Αριθμός ομολόγων | 4 | 3 | 2 | 1 |
| Αριθμός μοναχικών ζευγών | 0 | 1 | 2 | 3 |
Παραδείγματα εξάσκησης:Πώς να σχεδιάσετε μια δομή Lewis
Ποια είναι η δομή κουκίδων lewis του βορίου;

Όταν τοποθετείτε τις κουκκίδες, ξεκινήστε σχεδιάζοντας τις σε ξεχωριστές πλευρές μέχρι να γεμίσουν και τα τέσσερα σημεία. Αφού γεμίσουν όλα, τότε μπορείτε να προσθέσετε περισσότερες κουκκίδες στην ίδια πλευρά. Δεδομένου ότι το βόριο έχει 3 ηλεκτρόνια σθένους, θα υπάρχουν 3 κουκκίδες όλες τοποθετημένες σε διαφορετικές πλευρές
Ποια είναι η δομή κουκκίδας lewis για το υδροβρωμίδιο (HBr);
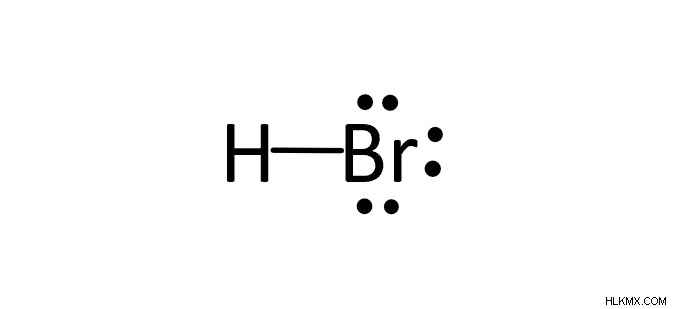
Ο συνολικός αριθμός ηλεκτρονίων θα ήταν 8. Υπάρχει ένας μόνο δεσμός που συνδέει υδρογόνο και βρώμιο. Εφόσον το υδρογόνο ικανοποιείται από δύο μόνο ηλεκτρόνια, τα υπόλοιπα ζεύγη θα καταλήξουν σε βρώμιο.
Ποια είναι η δομή κουκκίδας του τετραχλωράνθρακα (CCl4 )?
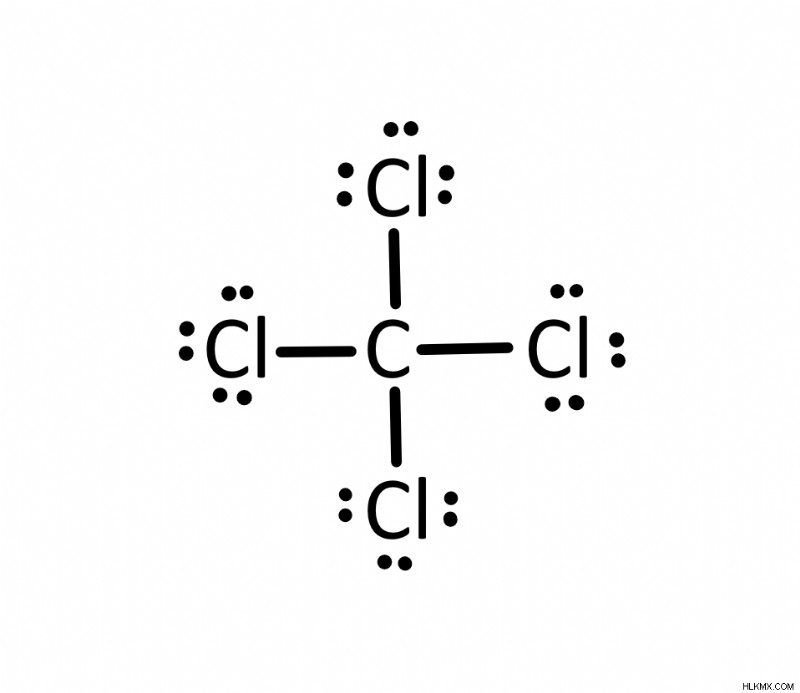
Υπάρχουν συνολικά 32 ηλεκτρόνια σθένους στον τετραχλωράνθρακα. Επιπλέον, ο άνθρακας θα ήταν το κεντρικό άτομο. Θα υπάρχουν τέσσερις απλοί δεσμοί που θα συνδέουν τον άνθρακα με τα χλώρια. Εφόσον ο άνθρακας έχει τέσσερις δεσμούς, ικανοποιείται από τον κανόνα της οκτάδας. Τα υπόλοιπα ηλεκτρόνια θα καταλήξουν στα άτομα χλωρίου.
Χρειάζεστε περισσότερα παραδείγματα; Ακολουθεί ένα φύλλο εργασίας




