K2SO4
Το θειικό κάλιο είναι ένα λευκό στερεό που έχει ευρύ φάσμα εφαρμογών στα λιπάσματα. Πολλοί από εμάς παίρνουμε βιταμίνες, μέταλλα και πρωτεΐνες με τη μορφή δισκίων ή άλλων συμπληρωμάτων για να μας βοηθήσουν να αποκτήσουμε τη διατροφή που χρειαζόμαστε. Αυτές οι ουσίες απαιτούνται για να αναπτυχθούμε, να επισκευάσουμε τον κατεστραμμένο ιστό ή απλώς να λειτουργήσουμε. Αυτό ισχύει για όλα τα έμβια όντα. Αυτό σημαίνει ότι τα φυτά, όπως και οι άνθρωποι, πρέπει να λαμβάνουν τις βιταμίνες τους και το κάλιο και το θείο είναι δύο από τα θρεπτικά συστατικά που χρειάζονται. Ευτυχώς, μπορούν να λάβουν και τα δύο από το θειικό κάλιο, ένα ανόργανο χημικό μόριο.
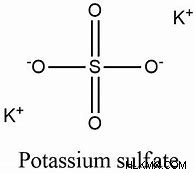
Χημικός τύπος:
Το K2SO4 είναι ο χημικός τύπος για το θειικό κάλιο. Υπάρχουν ιόντα καλίου (K+) και θειικού (SO42-). Ο χημικός τύπος για το θειικό κάλιο είναι:
Παραγωγή:
Η μέθοδος cross-cross μπορεί να χρησιμοποιηθεί για την εύρεση του χημικού τύπου για το θειικό κάλιο. Μπορούμε απλά να γράψουμε χημικούς τύπους χρησιμοποιώντας τη σταυρωτή προσέγγιση, η οποία χρησιμοποιεί τα σθένη των διαφόρων συστατικών. Το σύμβολο θετικού ή μεταλλικού ιόντος είναι γραμμένο στα αριστερά, ενώ το σύμβολο του αρνητικού είναι γραμμένο στα δεξιά. Ο αριθμός σθένους του θετικού μέρους γράφεται ως δείκτης στο σύμβολο του αρνητικού μέρους, ενώ ο αριθμός σθένους του αρνητικού μέρους γράφεται ως δείκτης στο σύμβολο του θετικού μέρους. Το πρώτο είναι ένα σπάνιο φαινόμενο. Τα αποδεικτικά στοιχεία των κατηγοριών απορρίπτονται. Ο χημικός τύπος του θειικού καλίου μπορεί τώρα να δηλωθεί ως Το θειικό κάλιο περιλαμβάνει ρίζες καλίου (K+) και θειικού (SO42-). Το ιόν καλίου έχει σθένος 1, ενώ η θειική ρίζα έχει σθένος δύο. Μπορούμε να γράψουμε τον χημικό τύπο του θειικού καλίου K2SO4
όπως διασταυρώνοντας τα σθένη.
Πηγές:
Οι φυσικές πηγές της χημικής ουσίας περιλαμβάνουν μέταλλα πλούσια σε αλάτι Stassfurt. Ο Καϊνίτης, ο Σχονίτης, ο Λεονίτης και ο Πολυαλίτης είναι μερικά από τα μέταλλα που περιέχουν θειικό κάλιο. Όταν το ισοδύναμο ορυκτό είναι αδιάλυτο στο νερό, είναι ευκολότερο να διαχωριστεί το θειικό κάλιο από αυτό. Εκτός από φυσικές πηγές, το θειικό κάλιο μπορεί επίσης να παραχθεί συνδυάζοντας το χλωριούχο κάλιο με μια ένωση θειικού μαγνησίου σε μια χημική αντίδραση.
Προετοιμασία:
Η αντίδραση μεταξύ χλωριούχου καλίου και θειικού οξέος παράγει θειικό κάλιο σε τεράστια κλίμακα. Αρχικά, ως ενδιάμεσο παράγεται όξινο θειικό κάλιο.
KCl + H2SO4 → HCl + KHSO4
Η παραπάνω αντίδραση είναι εξώθερμη και λαμβάνει χώρα σε θερμοκρασία δωματίου. Στο τελευταίο βήμα, το όξινο θειικό κάλιο αντιδρά με το χλωριούχο κάλιο για να παραχθεί θειικό κάλιο και υδροχλώριο.
KCl + KHSO4 → HCl + k2SO4
Η αντίδραση που περιγράφεται παραπάνω είναι ενδόθερμη.
Το υδροξείδιο του καλίου αντιδρά με το θειικό οξύ για να σχηματίσει θειικό οξύ.
Η αλληλεπίδραση υδροξειδίου του καλίου και θειικού οξέος παράγει θειικό κάλιο.
H2SO4 + KCl → k2SO4 + H2O
Το κάλιο και το θειικό οξύ αντιδρούν για να σχηματίσουν θειικό οξύ.
Όταν το κάλιο συνδυάζεται με αραιό θειικό οξύ, σχηματίζεται θειικό κάλιο.
2K + H2SO4 →K2SO4 + H2
Το όξινο ανθρακικό κάλιο αντιδρά με το θειικό οξύ και παράγει θειικό οξύ.
Όταν το διττανθρακικό κάλιο ενώνεται με το θειικό οξύ, σχηματίζεται θειικό κάλιο.
2KHCO3 + H2SO4 → k2SO4 + 2H2O + 2CO
Φυσικές ιδιότητες:
Το θειικό κάλιο είναι ένα υπόλευκο στερεό. Επίσης δεν έχει οσμή.
Διαλύεται καλά στο νερό και είναι ελαφρώς διαλυτό στη γλυκερίνη.
Στην ακετόνη, το αλκοόλ και το CS2, το θειικό κάλιο είναι αδιάλυτο.
Το θειικό κάλιο έχει θερμοκρασία τήξης 1342 βαθμούς Φαρενάιτ και σημείο βρασμού 1962 βαθμούς Φαρενάιτ.
Το θειικό κάλιο έχει πυκνότητα 2,66 g/cm3.
Χρησιμοποιεί:
Το θειικό κάλιο έχει ένα ευρύ φάσμα εφαρμογών. Είναι οι εξής:
Η πιο κοινή εφαρμογή θειικού καλίου είναι ως λίπασμα.
Το γυαλί είναι κατασκευασμένο με θειικό κάλιο, το οποίο είναι ένα είδος ακατέργαστου θειικού καλίου.
Το θειικό κάλιο χρησιμοποιείται ως καταστολέας λάμψης σε προωθητικές γομώσεις πυροβολικού.
Επειδή το θειικό κάλιο είναι πιο σκληρό από τη σόδα, χρησιμοποιείται ως εναλλακτικό μέσο έκρηξης στην ανατίναξη σόδας.
Το θειικό κάλιο χρησιμοποιείται στην πυροτεχνία για τη δημιουργία μωβ φλόγας όταν συνδυάζεται με νιτρικό κάλιο.
Το φλας του ρύγχους, η υπερπίεση και η ανάφλεξη μειώνονται όλα χρησιμοποιώντας θειικό κάλιο.
Το θειικό κάλιο είναι ένα οσμωτικό καθαρτικό που χρησιμοποιείται στην ιατρική.
Χρήσεις στη γεωργία:
Το κάλιο απαιτείται για πολλές ζωτικές εργασίες στα φυτά, συμπεριλαμβανομένης της ενεργοποίησης ενζύμων, της πρωτεϊνικής σύνθεσης, του σχηματισμού αμύλου και σακχάρου και ρύθμιση της ροής του νερού στα κύτταρα και τα φύλλα. Τα επίπεδα καλίου στο έδαφος είναι συχνά ανεπαρκή για τη διατήρηση της υγιούς ανάπτυξης των φυτών. Για τα φυτά, το θειικό κάλιο είναι μια εξαιρετική πηγή διατροφής με κάλιο. Το συστατικό Κ του K2SO4 είναι πανομοιότυπο με αυτό άλλων δημοφιλών λιπασμάτων ποτάσας. Παρέχει, ωστόσο, μια κρίσιμη πηγή θείου, το οποίο απαιτείται για τη σύνθεση πρωτεϊνών και τη λειτουργία των ενζύμων. Το θείο, όπως και το κάλιο, μπορεί να είναι ανεπαρκές για τη σωστή ανάπτυξη των φυτών. Οι προσθήκες Cl- θα πρέπει επίσης να αποφεύγονται σε ορισμένα εδάφη και καλλιέργειες. Σε τέτοιες περιπτώσεις, το K2SO4 είναι μια εξαιρετική πηγή καλίου.
Συμπέρασμα:
Το λίπασμα καλίου χρησιμοποιείται ευρέως για την ενίσχυση της απόδοσης και της ποιότητας των φυτών που αναπτύσσονται σε εδάφη που έχουν έλλειψη σε αυτό το ζωτικό συστατικό. Η πλειοψηφία των λιπασμάτων καλίου προέρχεται από αρχαία κοιτάσματα αλατιού σε όλο τον κόσμο. Η φράση "ποτάσα" είναι ένας ευρύς όρος που αναφέρεται σε μια ποικιλία λιπασμάτων που περιέχουν κάλιο, συμπεριλαμβανομένου του θειικού καλίου (K2SO4, συχνά γνωστό ως θειικό άλας ποτάσας ή SOP).




