Η διαδικασία Haber
Βασικές έννοιες
Σε αυτό το άρθρο, θα μάθετε για τη διαδικασία Haber και τη σημασία της, καθώς και για την κινητική, τη θερμοδυναμική και τους μηχανισμούς της.
Τι είναι η διαδικασία Haber;
Η διαδικασία Haber είναι μια βιομηχανική μέθοδος αντίδρασης αζώτου και αερίου υδρογόνου για την παραγωγή αμμωνίας. Στοιχειομετρικά, αυτό περιλαμβάνει ένα mole διατομικού αζώτου και τρία mole διατομικού υδρογόνου ανά δύο mole αμμωνίας.
Εξίσωση διαδικασίας Haber:N2 + 3H2 → 2NH3
Πολλοί χημικοί αποκαλούν τη διαδικασία Haber μια μορφή «δέσμευσης αζώτου», που σημαίνει τη μετατροπή του αερίου αζώτου σε μια πιο χρήσιμη χημικά μορφή. Στη φύση, οι μικροοργανισμοί που ονομάζονται διαζότροφοι εκτελούν δέσμευση αζώτου, η οποία βοηθά στον κύκλο του αζώτου μέσω των οικολογικών συστημάτων. Το άζωτο, φυσικά, χρησιμεύει ως ένα από τα θεμελιώδη στοιχεία της βιολογικής ζωής, αποτελώντας ένα σημαντικό μέρος των πρωτεϊνών και των νουκλεϊκών οξέων.
Το άζωτο, με τη μορφή αμμωνίας, έχει επίσης σημασία στην έρευνα και τις βιομηχανικές εφαρμογές. Ωστόσο, παρά το γεγονός ότι το διατομικό άζωτο χρησιμεύει ως το πιο άφθονο ατμοσφαιρικό αέριο, η έλλειψη αντιδραστικότητάς του καθιστούσε δύσκολο για τους χημικούς να αξιοποιήσουν.
Το 1909, ο Γερμανός χημικός Fritz Haber έγραψε επιστημονική ιστορία όταν έδειξε τη σύνθεση αμμωνίας από ατμοσφαιρικό άζωτο και υδρογόνο. Αργότερα το 1911, η μέθοδος βελτιώθηκε σημαντικά από έναν άλλο Γερμανό χημικό Carl Bosch, γεγονός που έκανε την αντίδραση πιο αποτελεσματική για τη βιομηχανία. Ως αποτέλεσμα, όταν εκτελείται σήμερα, πολλοί αναφέρονται στη μέθοδο ως διαδικασία Haber-Bosch.

Λόγω της εργασίας των Haber και Bosch, η αμμωνία μπορεί τώρα να συντεθεί εύκολα για διάφορους σημαντικούς σκοπούς, όπως λιπάσματα, εκρηκτικά, τεχνολογία ψύξης και φαρμακευτικά προϊόντα.
Αλλά τι ακριβώς κάνει τη διαδικασία Haber τόσο αποτελεσματική; Ας ρίξουμε μια πιο προσεκτική ματιά στη φυσική χημεία πίσω από την αντίδραση.
Η κινητική της διαδικασίας Haber
Εάν το αέριο άζωτο είναι τόσο αδρανές, πώς κατάφερε ο Fritz Haber να το κάνει να αντιδράσει; Για να ξεπεραστεί η μη αντιδραστικότητα του αζώτου, η διαδικασία Haber περιλαμβάνει δύο σημαντικούς παράγοντες. Ο πρώτος παράγοντας είναι ένας αποτελεσματικός καταλύτης.
Τα μεταβατικά μέταλλα χρησιμοποιούνται σχεδόν πάντα για να καταλύσουν τη διαδικασία Haber. Τις περισσότερες φορές, οι βιομηχανικοί χημικοί χρησιμοποιούν μαγνητίτη, ένα οξείδιο του σιδήρου (Fe3 O4 ), με μικρότερες ποσότητες υδροξειδίου του καλίου (KOH). Άλλοι κοινοί καταλύτες περιλαμβάνουν τα οξείδια του χρωμίου και του οσμίου.
Μηχανιστικά, ο καταλύτης πρέπει να συνδεθεί με το αέριο άζωτο. Αυτό επιτρέπει στο υδρογόνο να προστεθεί στους δεσμούς αζώτου έως ότου το άζωτο κορεσθεί πλήρως, αποδίδοντας αμμωνία. Χωρίς αυτή την κρίσιμη δέσμευση του καταλύτη, το άζωτο παραμένει αδρανές και μη αντιδραστικό, χωρίς ουσιαστικά να παράγει αμμωνία.
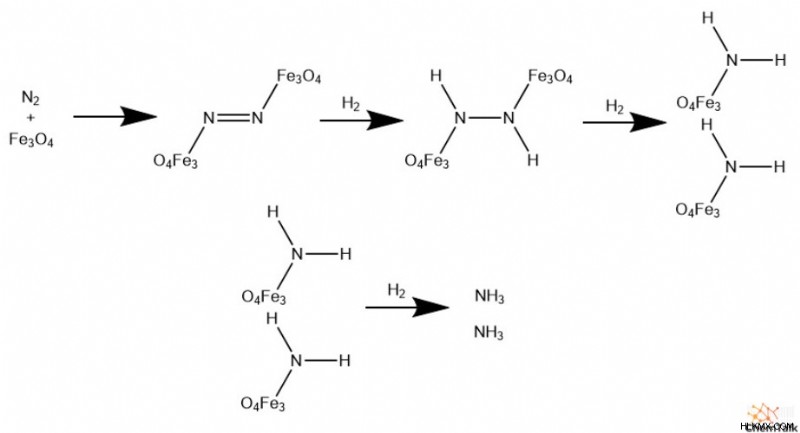
Ο δεύτερος παράγοντας για να αντιδράσει το άζωτο σχετίζεται με την πίεση. Συγκεκριμένα, υψηλότερες πιέσεις υποδηλώνουν περισσότερες μοριακές συγκρούσεις, γεγονός που αυξάνει τον ρυθμό αντίδρασης. Ως αποτέλεσμα, οι βιομηχανίες τείνουν να εκτελούν τη διαδικασία Haber στις υψηλότερες δυνατές πιέσεις, συχνά υψηλότερες από 200 ατμόσφαιρες.
Η θερμοδυναμική της διαδικασίας Haber
Με ή χωρίς καταλύτη, η αντίδραση που παράγει αμμωνία είναι αυθόρμητη (ΔG <0). Αυτό οφείλεται σε μια θεμελιώδη πτυχή της φυσικής χημείας:η κινητική και η θερμοδυναμική μιας αντίδρασης παραμένουν συχνά ανεξάρτητες η μία από την άλλη. Αν και μπορούμε να αντιληφθούμε ότι μια εξαιρετικά θερμοδυναμικά ευνοούμενη αντίδραση συμβαίνει πιο γρήγορα από μια λιγότερο ευνοούμενη, υπάρχουν εξαιρέσεις. Η διαδικασία Haber χρησιμεύει ως μια τέτοια εξαίρεση. μια αντίδραση με ευνοϊκή θερμοδυναμική αλλά απίστευτα αργή κινητική.
Εκτός από τον αυθορμητισμό, μπορούμε επίσης να παρατηρήσουμε ότι η αντίδραση έχει αρνητική μεταβολή στην εντροπία (ΔS <0). Συγκεκριμένα, βλέπουμε τέσσερα γραμμομόρια αντιδρώντος αερίου να παράγουν δύο γραμμομόρια αερίου προϊόντος.
N2 + 3H2 → 2NH3
Μια μείωση στα mol του αερίου δείχνει ότι το σύστημά μας έχει λιγότερες πιθανές μικροκαταστάσεις, υποδεικνύοντας φθίνουσα εντροπία. Μπορούμε επίσης να δικαιολογήσουμε την αρνητική αλλαγή λέγοντας ότι λιγότερα μόρια αερίου σημαίνει περισσότερη «διαταραχή».
Για να είναι η αντίδρασή μας αυθόρμητη παρά τη φθίνουσα εντροπία, η αντίδρασή μας πρέπει να έχει φθίνουσα ενθαλπία. Αυτό ισχύει πράγματι:η διαδικασία Haber είναι εξώθερμη (ΔH <0). Σύμφωνα με τον ορισμό της ελεύθερης ενέργειας Gibbs, ο αυθορμητισμός πρέπει να αυξάνεται καθώς η θερμοκρασία μειώνεται. Με άλλα λόγια, η μείωση της θερμοκρασίας καθιστά το ΔS λιγότερο σημαντικό, καθιστώντας το ΔG πιο αρνητικό:
∆G =∆H – T∆S
(Σε αυτήν την εξίσωση, T υποδεικνύει τη θερμοκρασία στην οποία λαμβάνει χώρα η αντίδραση)
Αυτό έχει σημαντικές επιπτώσεις για την ιδανική θερμοκρασία στην οποία θα εκτελεστεί η διαδικασία Haber, όπως παρατηρούμε στην επόμενη ενότητα.
Οι ιδιότητες ισορροπίας της διαδικασίας Haber
Όπως μόλις καλύψαμε, η διαδικασία Haber είναι εξώθερμη και αυξάνει τον αυθορμητισμό σε χαμηλότερες θερμοκρασίες. Με αυτές τις πληροφορίες, οι χημικοί μπορούν να αυξήσουν την απόδοση της αντίδρασης μειώνοντας τις θερμοκρασίες. Η εξήγηση για αυτό το φαινόμενο περιλαμβάνει τις αρχές της χημικής ισορροπίας.
Λόγω της εξωθερμικότητας, θα μπορούσαμε να πούμε ότι η θερμότητα χρησιμεύει ως «προϊόν» της αντίδρασης. Σύμφωνα με την Αρχή του L’Chatelier, μπορούμε να αλλάξουμε την ισορροπία ενός μείγματος αντίδρασης ασκώντας πίεση στο σύστημα. Η αντίδραση στη συνέχεια ανταποκρίνεται προς την κατεύθυνση για να εξουδετερώσει το στρες. Ψύχοντας το μείγμα, «αφαιρούμε» τη θερμότητα και το σύστημα εξουδετερώνει αυτή την πίεση παράγοντας περισσότερα προϊόντα. Έτσι, παίρνουμε περισσότερη αμμωνία σε χαμηλότερες θερμοκρασίες.
Ωστόσο, αν μειώσουμε τη θερμοκρασία πολύ, η κινητική της αντίδρασής μας μειώνεται καθώς τα μόρια δεν κινούνται τόσο γρήγορα. Για συμβιβασμούς, οι βιομηχανικοί χημικοί συνήθως ορίζουν τη θερμοκρασία αντίδρασης της διεργασίας Haber στους 450-500°C.
Η πλήρης διαδικασία Haber
Τώρα που γνωρίζουμε τη φυσική χημεία, ας ρίξουμε μια ματιά στην πλήρη διαδικασία.
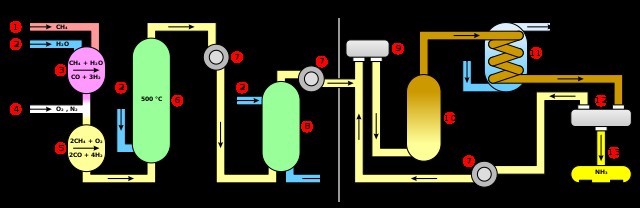
Ένα πράγμα που μπορεί να παρατηρήσετε είναι ότι το αέριο διυδρογόνο δεν εισάγεται απευθείας στο σύστημα. Αντίθετα, το μεθάνιο (1) και το νερό (2) αντιδρούν για να παράγουν υδρογόνο μέσα στο σύστημα (3). Αργότερα, οξυγόνο και αέριο άζωτο εισέρχονται στο σύστημα (4), το οποίο παράγει περαιτέρω υδρογόνο από μεθάνιο (5). Και στις δύο αντιδράσεις, το μονοξείδιο του άνθρακα σχηματίζεται ως υποπροϊόν.
Περαιτέρω υδρατμοί εισέρχονται στο σύστημα, οξειδώνοντας το μονοξείδιο του άνθρακα σε διοξείδιο του άνθρακα (6). Αυτό το διοξείδιο του άνθρακα στη συνέχεια φεύγει (8), παράγοντας ένα μείγμα αζώτου και αερίου υδρογόνου.
Αυτό το μείγμα αερίων συμπιέζεται σε περισσότερο από 200atm (7) και προθερμαίνεται στους ~500°C (9). Στη συνέχεια, το θερμαινόμενο και υπό πίεση μίγμα εισέρχεται στον θάλαμο αντίδρασης, εφοδιασμένο με τον καταλύτη μετάλλου μεταπτώσεως (10). Παράγεται μια ορισμένη ποσότητα αμμωνίας, η οποία αποστάζεται περνώντας ένα χιτώνιο κρύου νερού πάνω από το μείγμα αντίδρασης (11). Αυτό συμπυκνώνει την αέρια αμμωνία σε υγρό, το οποίο αποστραγγίζεται από το σύστημα (13).
Είναι σημαντικό ότι στην πρώτη δοκιμή, μόνο το 15% περίπου του αζώτου και του υδρογόνου θα έχει αντιδράσει. Το αέριο που δεν αντέδρασε διαχωρίζεται από την υγρή αμμωνία (12) και εισέρχεται ξανά στο θάλαμο αντίδρασης. Τελικά, περίπου το 98% του αρχικού μίγματος αερίων αντιδρά για να σχηματίσει αμμωνία μετά από αρκετές διαδρομές.




