Θετικοί Καταλύτες
Οι καταλύτες είναι ουσίες, όταν προστίθενται σε οποιαδήποτε χημική αντίδραση, μεταβάλλουν ή αλλάζουν τον ρυθμό μιας συνεχιζόμενης χημικής αντίδρασης. Με άλλα λόγια, οι καταλύτες είναι παράγοντες μεταβολής της ταχύτητας οποιασδήποτε χημικής αντίδρασης. Οι καταλύτες είναι δύο τύπων - θετικοί και αρνητικοί.
Οι θετικοί καταλύτες αλλάζουν τον ρυθμό αντίδρασης αυξάνοντας τον ρυθμό αντίδρασης και οι αρνητικοί καταλύτες αλλάζουν οποιαδήποτε χημική αντίδραση μειώνοντας τον ρυθμό αντίδρασης.
Θετικοί καταλύτες
Από τον ορισμό των καταλυτών, γνωρίζουμε ότι οι καταλύτες αλλάζουν τον πραγματικό ρυθμό χημικής αντίδρασης που βρίσκεται σε εξέλιξη. Ο όρος «θετικοί καταλύτες» υποδηλώνει ότι επηρεάζει θετικά τον ρυθμό οποιασδήποτε χημικής αντίδρασης αυξάνοντας τον ρυθμό αυτής της συνεχιζόμενης αντίδρασης. Στην αναστρέψιμη αντίδραση, ένας θετικός καταλύτης δεν θα αλλάξει τη θέση της ισορροπίας, αλλά θα προσπαθήσει να επιτύχει την κατάσταση ισορροπίας της αντίδρασης σε συντομότερο χρόνο.
Λειτουργία θετικών καταλυτών
Τα μόρια των αντιδρώντων απαιτούν μια ελάχιστη ποσότητα ενέργειας για να φτάσουν στο ενεργειακό σημείο κατωφλίου για να ολοκληρωθεί οποιαδήποτε χημική αντίδραση. Το ενεργειακό σημείο κατωφλίου είναι όταν σχηματίζεται ένα ενεργοποιημένο σύνθετο είδος. Εδώ, υπάρχουν μερικοί δεσμοί αντιδρώντος και μερικοί δεσμοί ενός προϊόντος ή μικτοί δεσμοί αντιδραστηρίου και προϊόντος. αυτό το ενεργοποιημένο σύνθετο είδος στη συνέχεια τελικά μετατρέπεται στο προϊόν της αντίδρασης.
Η απαιτούμενη ποσότητα ενέργειας είναι γνωστή ως ενέργεια ενεργοποίησης για να φτάσει στο ενεργειακό σημείο κατωφλίου. Ας υποθέσουμε ότι υπάρχουν καταλύτες σε οποιαδήποτε χημική αντίδραση. Σε αυτή την περίπτωση, παρέχει μια εναλλακτική διαδρομή προς τα μόρια των αντιδρώντων παρέχοντας λιγότερη ενέργεια ενεργοποίησης και ένα διαφορετικό είδος μεταβατικής κατάστασης από την αρχική ενέργεια ενεργοποίησης για τη συνεχιζόμενη χημική αντίδραση. Τέλος, αυξάνει τον ρυθμό αυτής της δεδομένης χημικής αντίδρασης.
Στη διαδικασία μιας καταλυόμενης χημικής αντίδρασης, οι καταλύτες δεν εμπλέκονται αποκλειστικά στην αντίδραση, παρέχουν μόνο την εναλλακτική διαδρομή παρέχοντας μερικές φορές την επιφάνειά του στο αντιδρόν για να αντιδράσει ή ο ίδιος να αντιδράσει με το αντιδραστήριο για να σχηματίσει το ενδιάμεσο είδος, και μετά την ολοκλήρωση της αντίδρασης, παίρνουμε το ίδιο προϊόν και καθαρό καταλύτη όπως έβαλα στην αρχική διάρκεια της αντίδρασης. 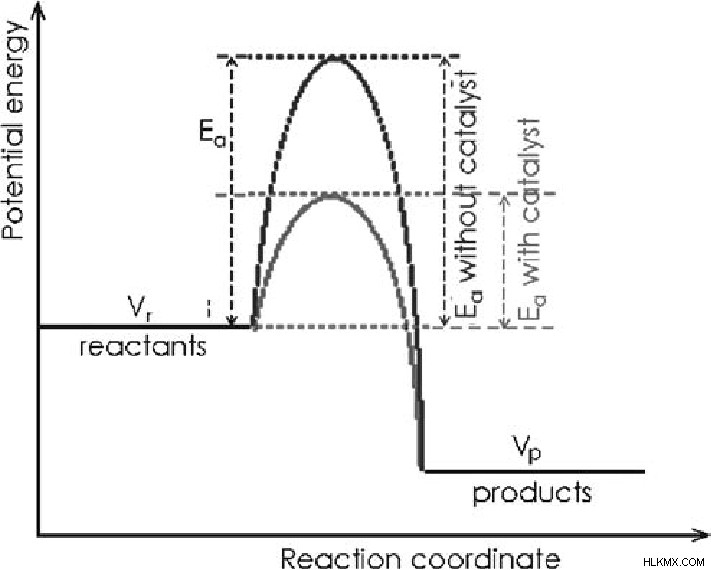
Παραδείγματα καταλυτών
Τα ένζυμα ανήκουν στην κατηγορία των θετικών καταλυτών και είναι γνωστά ως βιολογικοί καταλύτες καθώς αυξάνουν τον ρυθμό οποιασδήποτε χημικής αντίδρασης στο ανθρώπινο σώμα ως εξής:
H2CO3 (υδατ.) ↔ H2O(l) + CO2(g)
- Στην παραπάνω χημική αντίδραση, η καρβονική ανυδράση (H2CO3) είναι ο βιολογικός καταλύτης που αυξάνει τον ρυθμό διάχυσης του διοξειδίου του άνθρακα (CO2) από το αίμα προς τους πνεύμονες καθώς μπορούμε να εκπνέουμε τον άνθρακα αέριο διοξείδιο φθάνοντας στην κατάσταση ισορροπίας πολύ γρήγορα.
Το υπερμαγγανικό κάλιο (KMnO4) είναι επίσης ένας καταλύτης που αυξάνει τον ρυθμό της χημικής αντίδρασης αποσύνθεσης του υπεροξειδίου του υδρογόνου (H2O2), το οποίο με τη σειρά του μετατρέπεται σε αέριο οξυγόνο (O2) και νερό (Η2Ο) αυξάνοντας τη θερμοκρασία της αντίδρασης. Η θερμοκρασία αυξάνεται, αυξάνοντας τον ρυθμό σύγκρουσης των μορίων των αντιδρώντων και τον ρυθμό αντίδρασης.
Πολλά μέταλλα μετάπτωσης συμπεριφέρονται επίσης ως καταλύτες, αυξάνοντας τον ρυθμό πολλών χημικών αντιδράσεων όπως η πλατίνα (Pt). Η πλατίνα χρησιμοποιείται στα αυτοκίνητα ως μετατροπέας.
Η μαύρη πλατίνα χρησιμοποιείται επίσης ως θετικός καταλύτης καθώς αυξάνει την πιθανότητα συνδυασμού αερίου οξυγόνου (O2) και αερίου υδρογόνου (H2) για σχηματισμό μορίων νερού.
2H2 + O2 —(Pt)– 2H2O
Το οξείδιο του αζώτου (NO) είναι ένας άλλος θετικός καταλύτης που αυξάνει τον ρυθμό χημικής αντίδρασης της οξείδωσης του SO2 σε SO3.
Το διοξείδιο του μαγγανίου είναι επίσης θετικός καταλύτης καθώς αυξάνει τον ρυθμό αποσύνθεσης του χλωρικού καλίου (KClO3) σε χλωριούχο κάλιο (KCl) και αέριο οξυγόνο, οπότε το οξυγόνο που προκύπτει αέριο (O2) θα απελευθερωθεί.
2KClO3 (s) –−−(∆, MnO2)−−→ 2KCl(s) + 3O2(g)
Ο σίδηρος (Fe) είναι θετικός καταλύτης στη διαδικασία σύνθεσης αμμωνίας.
Οι ζεόλιθοι είναι θετικός καταλύτης στη διαδικασία πυρόλυσης πετρελαίου.
Το νικέλιο, το παλλάδιο και η πλατίνα είναι θετικοί καταλύτες στη διαδικασία υδρογόνωσης ακόρεστων υδρογονανθράκων.
Συμπέρασμα
Ο θετικός καταλύτης είναι μια ουσία που αυξάνει τον ρυθμό οποιασδήποτε συνεχιζόμενης χημικής αντίδρασης συμμετέχοντας μόνο στην αντίδραση και χωρίς να καταναλώνεται από το είδος της αντίδρασης. Ο ρυθμός μιας χημικής αντίδρασης παρουσία καταλύτη αυξάνεται λόγω της μειωμένης ενέργειας ενεργοποίησης των εμπλεκόμενων αντιδρώντων.




