Διαφορά μεταξύ απορρόφησης και προσρόφησης
Κύρια διαφορά – Απορρόφηση έναντι Προσρόφησης
Τόσο η Απορρόφηση όσο και η Προσρόφηση είναι φυσικοχημικές διεργασίες όπου μια σχετικά μικρή ποσότητα ενός είδους εισέρχεται/προσκολλάται σε ένα άλλο είδος σχετικά μεγαλύτερης ποσότητας. Ο τρόπος με τον οποίο τα υλικά ενσωματώνονται μεταξύ τους διαφοροποιεί σαφώς τις δύο διαδικασίες. Όταν μια μικρή ποσότητα ενός υλικού εισέρχεται πλήρως και απλώνεται σε ολόκληρο τον όγκο ενός άλλου υλικού, ονομάζεται, «απορρόφηση. Αντίθετα, όταν μια μικρή ποσότητα ενός υλικού προσκολλάται μόνο στην εξωτερική επιφάνεια του άλλου υλικού, ονομάζεται «προσρόφηση .» Επομένως, η κύρια διαφορά μεταξύ απορρόφησης και προσρόφησης είναι, απορρόφηση είναι η κατανομή μιας συγκεκριμένης ουσίας σε όλο τον όγκο ενός άλλου υποστρώματος ενώ προσρόφηση είναι η προσκόλληση μιας συγκεκριμένης ουσίας στην επιφάνεια ενός άλλου υποστρώματος .
Τι είναι η Απορρόφηση
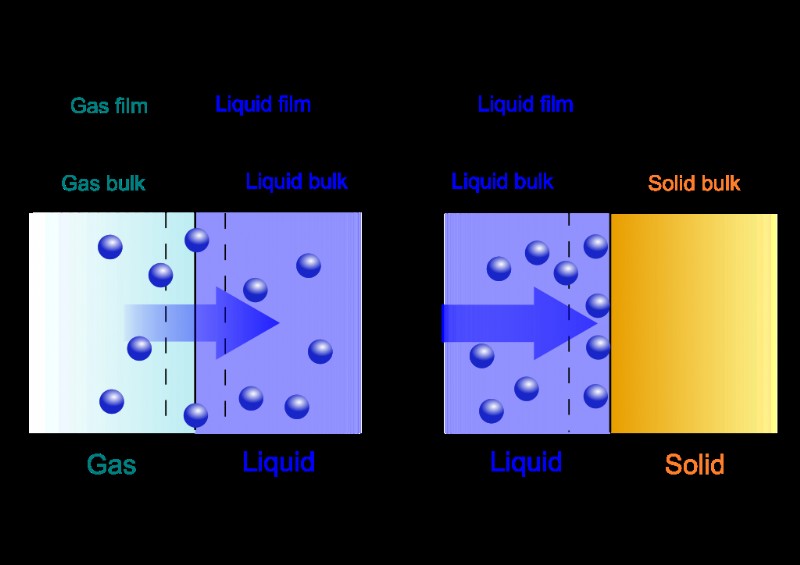
Όπως αναφέρθηκε παραπάνω, όταν λέμε ότι ένα συγκεκριμένο υλικό απορροφάται από ένα άλλο υλικό, σημαίνει ότι το πρώτο υλικό εισέρχεται και απλώνεται πλήρως στο δεύτερο υλικό σε όλο τον όγκο του που καταλαμβάνει χώρο ανάλογα με τη συγκέντρωση . Επομένως, θεωρητικά, τα άτομα, τα μόρια και τα ιόντα μπορούν να εισέλθουν σε μια άλλη αέρια, υγρή ή στερεή χύδην φάση. Με βάση τους ρυθμούς απορρόφησης διαφορετικών ουσιών από απορροφητικά (το υλικό που απορροφά το ξένο υλικό), έχουν δημιουργηθεί διάφοροι μηχανισμοί διαχωρισμού. Για παράδειγμα, εκχύλιση υγρού-υγρού για χημικές ουσίες. Σε αυτήν την περίπτωση, μια ορισμένη ουσία που είχε απορροφηθεί από ένα υγρό έρχεται σε επαφή με ένα άλλο υγρό που έχει μεγαλύτερη συγγένεια με την ουσία και ως εκ τούτου κατανέμεται στο δεύτερο υγρό όπου μπορεί να εκχυλιστεί.
Ομοίως, ένα άλλο παράδειγμα θα ήταν η απορρόφηση οξυγόνου στο νερό όπου όλη η ποσότητα του αερίου διαλύεται και κατανέμεται εξίσου σε όλο τον όγκο του νερού. Εδώ, το αέριο αρχικά διαλύεται μετά από μια αρχική επαφή με την επιφάνεια. Και η ποσότητα που μεταφέρεται εξαρτάται τελικά από τα χαρακτηριστικά τόσο του υγρού όσο και του αερίου. Αυτός ο τύπος απορρόφησης ονομάζεται «φυσική απορρόφηση». Η απορρόφηση μπορεί να κατηγοριοποιηθεί ευρέως σε φυσική απορρόφηση και χημική απορρόφηση όπου στην τελευταία περίπτωση θα οφείλεται σε χημική αντίδραση και όχι σε μαζική μεταφορά ανάλογα με τα χαρακτηριστικά των εμπλεκόμενων υλικών.
α) Απορρόφηση αερίου-υγρού β) προσρόφηση υγρού-στερεού
Τι είναι η προσρόφηση
Η προσρόφηση είναι ένα "επιφανειακό φαινόμενο" και αποκλίνει αυστηρά από την απορρόφηση που περιλαμβάνει ολόκληρο τον όγκο του υλικού. Επομένως, στην περίπτωση της προσρόφησης, μια σχετικά μικρή ποσότητα μιας ουσίας θα προσκολληθεί στην επιφάνεια του χύδην υποστρώματος ως αποτέλεσμα διαφόρων τύπων αλληλεπιδράσεων . Η ουσία που απορροφάται ονομάζεται «προσροφητικό». και το υπόστρωμα που απορροφά το εισερχόμενο υλικό ονομάζεται «απορροφητικό». Στην περίπτωση της Physisorption , ο τύπος των αλληλεπιδράσεων μεταξύ του προσροφητικού και του προσροφητικού είναι φυσικές δυνάμεις όπως οι αλληλεπιδράσεις Van der Waals. Ωστόσο, στην περίπτωση της Χημειορρόφησης , είναι χημικοί δεσμοί που δεσμεύουν τα προσροφημένα με το προσροφητικό.
Η συλλογιστική πίσω από την προσρόφηση είναι παρόμοια με την επιφανειακή τάση. Τα μόρια μέσα στο προσροφητικό περιβάλλονται από άλλα μόρια προσροφητικού και η ενέργειά τους στις επιφάνειες εξουδετερώνεται. Δεν ισχύει όμως για το εξωτερικό επιφανειακό στρώμα του προσροφητικού καθώς δεν περιβάλλεται από άλλα μόρια. Επομένως, η επιφάνεια ενός προσροφητικού έχει επιπλέον ενέργεια στα εσωτερικά στρώματα. Ως εκ τούτου, απορροφά άλλα μόρια στην επιφάνειά τους για να ελαχιστοποιήσει την επιφανειακή ενέργεια. .Ωστόσο, η διαφορά μεταξύ προσρόφησης και απορρόφησης σχεδόν εξαφανίζεται σε μικρομοριακή κλίμακα όταν η επιφάνεια του προσροφητικού είναι σημαντικά μεγάλη.
Διαφορά μεταξύ απορρόφησης και προσρόφησης
Ορισμός
Απορρόφηση είναι η κατανομή μιας ορισμένης ουσίας σε όλο τον όγκο ενός άλλου υποστρώματος.
Απορρόφηση είναι η προσκόλληση μιας συγκεκριμένης ουσίας στην επιφάνεια ενός άλλου υποστρώματος.
Διαδικασίες διαχωρισμού
Απορροφήθηκε Τα υλικά μπορούν να διαχωριστούν μεταξύ διαφορετικών φάσεων λόγω των χημικών τους χαρακτηριστικών.
Η τεχνική της προσρόφησης μπορεί να χρησιμοποιηθεί για τον διαχωρισμό ορισμένων υλικών με την προσρόφησή τους σε μια επιφάνεια ενώ η ροή ενός άλλου υλικού που είχε προηγουμένως απορροφήσει την ουσία.
Ενέργεια
Τα υλικά απορροφούνται σε άλλο υλικό μέσω της διαθεσιμότητας χώρου και επίσης λόγω των ιδιοτήτων κάθε υλικού.
Η κενή επιφάνεια του προσροφητικού έχει επιπλέον ενέργεια που διεγείρει την προσκόλληση ξένων μορίων σε αυτό.
Σύνδεση
Υλικά που απορροφούνται παραμένουν εντός του χώρου του απορροφητικού χωρίς να έχουν χημική σχέση να είναι απολύτως άθικτο όπως όταν είναι ελεύθερο. Μπορεί να έχει μόνο αδύναμες φυσικές αλληλεπιδράσεις.
Στην προσρόφηση, το προσροφάται δεσμεύονται στην επιφάνεια του προσροφητικού συνήθως μέσω αλληλεπιδράσεων Van der Waals ή μέσω ομοιοπολικών δεσμών.





