Διαφορά μεταξύ μαγγανίου και μαγνησίου
Κύρια διαφορά – Μαγγάνιο vs Μαγνήσιο
Ένα χημικό στοιχείο είναι ένα χημικό είδος που αντιπροσωπεύει τα άτομα που έχουν τον ίδιο αριθμό πρωτονίων στον πυρήνα των ατόμων τους. Όλα τα χημικά στοιχεία που έχουν ανακαλυφθεί μέχρι τώρα τοποθετούνται στον περιοδικό πίνακα των στοιχείων. Αυτός ο περιοδικός πίνακας στοιχείων δείχνει τα χημικά στοιχεία σύμφωνα με την αύξουσα σειρά του αριθμού των πρωτονίων τους στον πυρήνα. Το μαγγάνιο και το μαγνήσιο είναι τέτοια χημικά στοιχεία. Το μαγγάνιο έχει 25 πρωτόνια στο άτομό του. Το μαγνήσιο έχει 12 πρωτόνια στο άτομό του. Το μαγγάνιο και το μαγνήσιο έχουν διαφορετικές χημικές και φυσικές ιδιότητες. Η εμφάνισή τους είναι επίσης διαφορετική μεταξύ τους. Ωστόσο, η κύρια διαφορά μεταξύ μαγγανίου και μαγνησίου είναι ότι το σημείο τήξης του μαγγανίου είναι περίπου 1246 C, που είναι μια πολύ υψηλή τιμή ενώ το σημείο τήξης του μαγνησίου είναι περίπου 650 C, που είναι συγκριτικά χαμηλότερη τιμή από αυτό του μαγγανίου.
Βασικές περιοχές που καλύπτονται
1. Τι είναι το Μαγγάνιο
– Ορισμός, ιδιότητες και αντιδράσεις
2. Τι είναι το Μαγνήσιο
– Ορισμός, ιδιότητες και αντιδράσεις
3. Ποια είναι η διαφορά μεταξύ μαγγανίου και μαγνησίου
– Σύγκριση βασικών διαφορών
Βασικοί όροι:Ατομικός αριθμός, Ηλεκτραρνητικότητα, Μαγνήσιο, Μαγγάνιο, Πρωτόνια
Τι είναι το Μαγγάνιο
Το μαγγάνιο είναι ένα χημικό στοιχείο που δίνεται από το σύμβολο Mn. Ο ατομικός αριθμός του μαγγανίου είναι 25. Επομένως, αποτελείται από 25 πρωτόνια στον πυρήνα του. Το ατομικό βάρος του μαγγανίου είναι περίπου 54,93 amu. Η ηλεκτρονική διαμόρφωση του μαγγανίου δίνεται ως [Ar]3d4s. Επομένως, το μαγγάνιο ανήκει στην ομάδα 7 στο μπλοκ d του περιοδικού πίνακα. Το μαγγάνιο είναι ένα στοιχείο μπλοκ. Θεωρείται ως μεταβατικό μέταλλο.
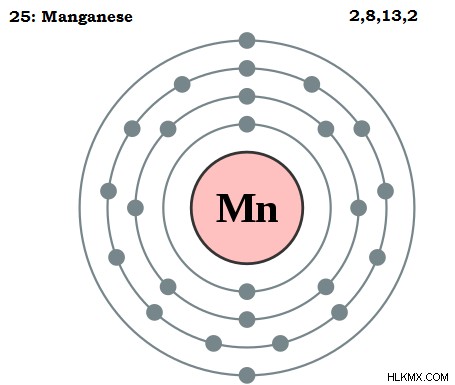
Εικόνα 1:Ατομική δομή μαγγανίου
Σε τυπικές συνθήκες θερμοκρασίας και πίεσης, το μαγγάνιο βρίσκεται στη στερεή φάση. Το σημείο τήξης του μαγγανίου είναι περίπου 1246 C. Είναι πολύ υψηλή τιμή. Το μαγγάνιο μπορεί να υπάρχει σε διάφορες καταστάσεις οξείδωσης σε ενώσεις. Οι καταστάσεις οξείδωσης ποικίλλουν από +7 έως -3. Η ηλεκτραρνητικότητα του μαγγανίου δίνεται ως 1,55. Η ατομική ακτίνα του μαγγανίου είναι περίπου 127 μ.μ. λόγω της παρουσίας d τροχιακών.
Το μαγγάνιο θεωρείται παραμαγνητική ένωση. Αυτό οφείλεται στην παρουσία ασύζευκτων ηλεκτρονίων στα τροχιακά του. Σε θερμοκρασία και πίεση δωματίου, το μαγγάνιο είναι ένα πολύ σκληρό και εύθραυστο μέταλλο. Επιπλέον, το μαγγάνιο έχει πολλά φυσικά και συνθετικά ισότοπα. Αλλά το Mn είναι το 100% σταθερό και άφθονο ισότοπο, ενώ άλλα ισότοπα βρίσκονται σε πολύ ίχνη.
Δεδομένου ότι το μαγγάνιο μπορεί να έχει πολλές διαφορετικές καταστάσεις οξείδωσης, μπορεί να βρεθεί σε διάφορους τύπους στερεών και υγρών ενώσεων σε διαφορετικές καταστάσεις οξείδωσης. Μια πιο κοινή ένωση είναι το KMnO4 (υπερμαγγανικό κάλιο). Είναι σε σκούρο βιολετί χρώμα όταν είναι στερεό και μπορεί εύκολα να διαλυθεί σε νερό σχηματίζοντας MnO4 ιόντων. Αυτό το διάλυμα έχει επίσης ένα βαθύ μωβ χρώμα. Εδώ, το άτομο μαγγανίου βρίσκεται σε κατάσταση οξείδωσης +7, η οποία είναι η υψηλότερη κατάσταση οξείδωσης που μπορεί να έχει το μαγγάνιο.

Εικόνα 2:Στερεή ένωση υπερμαγγανικού καλίου
Το μαγγάνιο χρησιμοποιείται στην παραγωγή χάλυβα. Ο ρόλος του μαγγανίου στην παραγωγή χάλυβα είναι να δρα ως αποοξειδωτικός και κράμα παράγοντας. Επιπλέον, το μαγγάνιο χρησιμοποιείται στην παραγωγή κραμάτων αλουμινίου. Εκτός από αυτό, το μαγγάνιο είναι χρήσιμο σε πολλά χημικά είδη που χρειάζονται σε εφαρμογές εργαστηριακής κλίμακας.
Τι είναι το Μαγνήσιο
Το μαγνήσιο είναι ένα χημικό στοιχείο που έχει το σύμβολο Mg. Τοποθετείται στην ομάδα 2, περίοδος 3 του περιοδικού πίνακα των στοιχείων. Ο ατομικός αριθμός του μαγνησίου είναι 12. Αυτό σημαίνει ότι το μαγνήσιο έχει 12 πρωτόνια στον πυρήνα. Σε συνθήκες θερμοκρασίας και πίεσης δωματίου, το μαγνήσιο βρίσκεται σε στερεή φάση. Η ηλεκτρονιακή διαμόρφωση του μαγνησίου είναι [Ne]3s. Επομένως, μπορεί να έχει καταστάσεις οξείδωσης 0 και +2.

Εικόνα 3:Κρύσταλλοι μαγνησίου
Το σημείο τήξης του μαγνησίου είναι περίπου 650C. Η ατομική μάζα του μαγνησίου δίνεται ως 24 amu. Βρίσκεται στο μπλοκ s του περιοδικού πίνακα. Το μαγνήσιο και άλλα στοιχεία της ίδιας ομάδας θεωρούνται μέταλλα αλκαλικών γαιών. Αυτό συμβαίνει γιατί τα οξείδια που σχηματίζουν έχουν βασικά χαρακτηριστικά. Η ηλεκτραρνητικότητα του μαγνησίου είναι περίπου 1,31. Η ατομική ακτίνα του μαγνησίου είναι περίπου 160 μ.μ.
Το μαγνήσιο έχει τρία σταθερά ισότοπα. Το πιο άφθονο ισότοπο είναι το Mg. Η αφθονία του είναι περίπου 79%. Αλλά το μαγνήσιο έχει επίσης ραδιενεργά ισότοπα. Το μαγνήσιο μπορεί να αντιδράσει με νερό σε θερμοκρασία δωματίου. Αυτή η αντίδραση σχηματίζει υδροξείδιο του μαγνησίου και φυσαλίδες αερίου υδρογόνου εκλύονται από το νερό κατά τη διάρκεια αυτής της αντίδρασης. Το μαγνήσιο μπορεί επίσης να αντιδράσει με πολλά οξέα, σχηματίζοντας το ιόν Mg και το αέριο υδρογόνο. Το μαγνήσιο είναι πολύ εύφλεκτο. Μπορεί να καεί στον αέρα, με αποτέλεσμα μια πολύ γυαλιστερή λευκή φλόγα.

Εικόνα 4:Καύση μαγνησίου στον αέρα
Το μαγνήσιο μπορεί να βρεθεί κυρίως σε κοιτάσματα ορυκτών. Τέτοια ορυκτά είναι ο δολομίτης και ο μαγνησίτης. Το θαλασσινό νερό έχει επίσης σημαντική ποσότητα ιόντων μαγνησίου διαλυμένα σε αυτό. Το μαγνήσιο έχει ευρείες εφαρμογές ως μέταλλο, ειδικά στον σχεδιασμό αεροσκαφών και στον σχεδιασμό αυτοκινήτων.
Διαφορά μεταξύ μαγγανίου και μαγνησίου
Ορισμός
Μαγγάνιο: Το μαγγάνιο είναι ένα χημικό στοιχείο που δίνεται με το σύμβολο Mn.
Μαγνήσιο: Το μαγνήσιο είναι ένα χημικό στοιχείο που έχει το σύμβολο Mg.
Ατομικός αριθμός
Μαγγάνιο: Ο ατομικός αριθμός του μαγγανίου είναι 25.
Μαγνήσιο: Ο ατομικός αριθμός του μαγνησίου είναι 12.
Ατομικό βάρος
Μαγγάνιο: Το ατομικό βάρος του μαγγανίου είναι περίπου 54 amu.
Μαγνήσιο: Το ατομικό βάρος του μαγνησίου είναι περίπου 24 amu.
Σημείο τήξης
Μαγγάνιο: Το σημείο τήξης του μαγγανίου είναι περίπου 1246 C.
Μαγνήσιο: Το σημείο τήξης του μαγνησίου είναι περίπου 650 C.
Ατομική ακτίνα
Μαγγάνιο: Η ατομική ακτίνα του μαγγανίου είναι περίπου 127 μ.μ.
Μαγνήσιο: Η ατομική ακτίνα μαγνησίου είναι περίπου 160 μ.μ.
Τοποθεσία στον περιοδικό πίνακα
Μαγγάνιο: Το μαγγάνιο βρίσκεται στο μπλοκ d του περιοδικού πίνακα των στοιχείων.
Μαγνήσιο: Το μαγνήσιο βρίσκεται στο μπλοκ s του περιοδικού πίνακα των στοιχείων.
Διαμόρφωση ηλεκτρονίων
Μαγγάνιο: Η ηλεκτρονική διαμόρφωση του μαγγανίου είναι [Ar]3d4s
Μαγνήσιο: Η ηλεκτρονική διαμόρφωση του μαγνησίου είναι [Ne]3s
Ηλεκτραρνητικότητα
Μαγγάνιο: Η ηλεκτροαρνητικότητα του μαγγανίου είναι περίπου 1,55
Μαγνήσιο: Η ηλεκτροαρνητικότητα του μαγνησίου είναι περίπου 1,31
Καταστάσεις οξείδωσης
Μαγγάνιο: Το μαγγάνιο μπορεί να έχει καταστάσεις οξείδωσης από -3 έως +7.
Μαγνήσιο: Το μαγνήσιο μπορεί να έχει καταστάσεις οξείδωσης 0 και +2.
Συμπέρασμα
Το μαγγάνιο και το μαγνήσιο είναι χημικά στοιχεία που βρίσκονται σε αφθονία στον φλοιό της γης. Και τα δύο είναι μέταλλα. Αν και τα δύο ονόματα είναι λίγο μπερδεμένα, παρουσιάζουν πολύ διακριτές φυσικές και χημικές ιδιότητες. Η κύρια διαφορά μεταξύ μαγγανίου και μαγνησίου είναι ότι το σημείο τήξης του μαγγανίου είναι περίπου 1246 C που είναι μια πολύ υψηλή τιμή ενώ το σημείο τήξης του μαγνησίου είναι περίπου 650 C, το οποίο είναι συγκριτικά χαμηλότερη τιμή από αυτό του μαγγανίου.




