Διαφορά μεταξύ μορίου και μορίου
Κύρια διαφορά – Mole vs Molecule
Το μόριο και το μόριο είναι δύο διακριτοί όροι που χρησιμοποιούνται στη χημεία. Ο όρος mole χρησιμοποιείται για να αντιπροσωπεύει μια ποσότητα που δεν μπορεί να μετρηθεί με μονάδες όπως γραμμάρια ή χιλιοστόγραμμα. Επομένως, ένα mol μετρά τον αριθμό των ατόμων, ιόντων ή μορίων. Ένα μόριο είναι ένα χημικό είδος που σχηματίζεται λόγω του συνδυασμού πολλών ατόμων μέσω χημικών δεσμών. Ένα μόριο δεν φέρει κανένα ηλεκτρικό φορτίο. Τα άτομα που δημιουργούν ένα μόριο μπορεί να είναι του ίδιου στοιχείου ή διαφορετικών στοιχείων. Η αναλογία μεταξύ αυτών των ατόμων είναι διαφορετική από το ένα μόριο στο άλλο. Ο αριθμός των μορίων που υπάρχουν σε ένα σύστημα μπορεί να μετρηθεί σε mol. Η κύρια διαφορά μεταξύ mole και μορίου είναι ότι το mole είναι μια μονάδα μέτρησης της ποσότητας ενώ το μόριο είναι ένα χημικό είδος που αποτελείται από άτομα.
Βασικές περιοχές που καλύπτονται
1. Τι είναι ο Τυφλοπόντικας
– Ορισμός, Ιστορικό, Εφαρμογές
2. Τι είναι ένα Μόριο
– Ορισμός, τύποι και χρήσεις
3. Ποια είναι η διαφορά μεταξύ μορίου και μορίου
– Σύγκριση βασικών διαφορών
Βασικοί όροι:Atom, Avogadro's Number, Ion, Mole, Molecule
Τι είναι ο τυφλοπόντικας
Ένα mole είναι η ποσότητα οτιδήποτε έχει τον ίδιο αριθμό ατόμων σε 12,0 g ισοτόπου C. Η τιμή ενός mole δίνεται ως 6,023 x 10. Αυτή η τιμή ονομάζεται αριθμός Avogadro. Αυτό σημαίνει ότι 12,0 g ισοτόπου C αποτελείται από 6,023 x 10 άτομα άνθρακα. Με άλλα λόγια, ένα mole άνθρακα αποτελείται από έναν αριθμό Avogadro ατόμων άνθρακα.
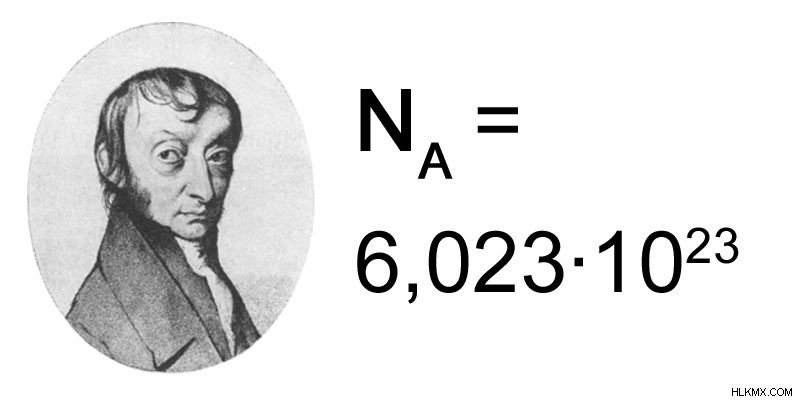
Εικόνα 1:Ο αριθμός του Avogadro
Ο αριθμός των σπίλων μπορεί να δοθεί από τη μονάδα "mol". Ο όρος mole μπορεί να χρησιμοποιηθεί με οποιοδήποτε χημικό είδος όπως άτομα, μόρια, ιόντα κ.λπ. Επομένως, ένα mole θείου σημαίνει 1 mol ατόμων θείου. Ένα mole διοξειδίου του άνθρακα σημαίνει, 1 mol CO2 μόρια.
Όταν πρόκειται για το ατομικό επίπεδο, μονάδες όπως τα γραμμάρια ή τα χιλιοστόγραμμα δεν είναι τόσο χρήσιμες, καθώς πρέπει να μετράμε πολύ μικρές ποσότητες. Το 1805, ο John Dalton δημιούργησε τον πρώτο τυπικό πίνακα ατομικού βάρους που αποτελείται από το ατομικό βάρος κάθε στοιχείου σε σχέση με το υδρογόνο. Το ατομικό βάρος του υδρογόνου λήφθηκε ως 1. Επομένως, αυτές ήταν σχετικές ατομικές μάζες. Αργότερα, με την ανάπτυξη της ατομικής θεωρίας, η έννοια του mole εισήχθη από τον Wilhelm Ostwald, έναν Γερμανό επιστήμονα. Από τότε, το mole έγινε μια βασική μονάδα SI που συμβολίζεται με το "mol."
Ο τυφλοπόντικας είναι ένας ευρέως χρησιμοποιούμενος όρος στις χημικές αντιδράσεις. Η ποσότητα του προϊόντος που μπορεί να ληφθεί από μια ορισμένη ποσότητα αντιδρώντων μπορεί να προβλεφθεί με τον προσδιορισμό των γραμμομοριακών αναλογιών μεταξύ των αντιδρώντων και των προϊόντων μιας χημικής αντίδρασης. Το ατομικό βάρος δίνεται ως η μάζα ενός mol αυτού του στοιχείου. Εάν όχι, είναι πολύ δύσκολο να χειριστείτε το βάρος των ατόμων, καθώς είναι μια πολύ μικρή τιμή.
Για παράδειγμα,
Το βάρος ενός ατόμου οξυγόνου =2,6 x 10 kg.
Ένα mole οξυγόνου αποτελείται από 6,023 x 10 άτομα οξυγόνου
Το βάρος ενός γραμμομόρου οξυγόνου =(2,6 x 10 x 6,023 x 10)
=15,9 g.
Η ατομική μάζα του οξυγόνου =15,9 g/mol.
Ο χειρισμός μιας τιμής όπως το 15,99 (περίπου 16) είναι εύκολος από τον χειρισμό 2,6 x 10 g. Επομένως, η έννοια του σπίλου είναι πολύ σημαντική στις μελέτες.
Τι είναι ένα μόριο
Ένα μόριο είναι ένα χημικό είδος που σχηματίζεται λόγω ενός συνδυασμού πολλών ατόμων μέσω χημικών δεσμών. Αυτοί οι δεσμοί μπορεί να είναι ομοιοπολικοί δεσμοί, ιοντικοί δεσμοί ή δεσμοί συντονισμού. Αυτοί οι συνδυασμοί ατόμων μπορεί να περιλαμβάνουν τα άτομα του ίδιου στοιχείου ή διαφορετικών στοιχείων. Επιπλέον, η αναλογία μεταξύ αυτών των ατόμων σε ένα μόριο είναι μοναδική σε αυτό το μόριο. Αν αλλάξει ο συνδυασμός, προκύπτει ένα νέο μόριο. Για παράδειγμα, O2 είναι ένα μόριο, O3 είναι επίσης ένα μόριο. Αλλά είναι διαφορετικά μόρια.
Τα μεμονωμένα άτομα δεν είναι μόρια. Οι ενώσεις είναι μόρια που αποτελούνται από πολλά διαφορετικά στοιχεία. Επομένως, όλα τα μόρια δεν είναι ενώσεις επειδή ορισμένα μόρια αποτελούνται από άτομα μόνο ενός στοιχείου όπως το H2 και O2 .
Εικόνα 2:Τα μόρια μπορούν να βρεθούν είτε ως απλά μόρια είτε ως σύνθετα μόρια.
Η παραπάνω εικόνα δείχνει ένα σύνθετο μόριο που αποτελείται από μεγάλο αριθμό ατόμων συνδεδεμένα μεταξύ τους μέσω ομοιοπολικών δεσμών.
Τα μόρια μπορούν να βρεθούν ως διατομικά μόρια, τριατομικά μόρια κ.λπ. Ένα μόριο μπορεί να έχει ιοντικούς δεσμούς ή ομοιοπολικούς δεσμούς. Για παράδειγμα, το μόριο NaCl έχει έναν ιοντικό δεσμό μεταξύ ατόμων Na και Cl. SO3 Το μόριο έχει ομοιοπολικούς δεσμούς μεταξύ του κεντρικού ατόμου θείου και των ατόμων οξυγόνου. Σε ενώσεις όπως το NH3 BF3 , υπάρχουν ομοιοπολικοί δεσμοί και ένας δεσμός συντονισμού. Ωστόσο, όλα αυτά είναι μόρια.
Διαφορά μεταξύ Mole και Molecule
Ορισμός
Τυφλοπόντικα: Ένα mole είναι η ποσότητα οτιδήποτε έχει τον ίδιο αριθμό ατόμων σε 12,0 g ισοτόπου C.
Μόριο: Ένα μόριο είναι ένα χημικό είδος που σχηματίζεται λόγω ενός συνδυασμού πολλών ατόμων μέσω χημικών δεσμών.
Εφαρμογές
Τυφλοπόντικα: Το mole χρησιμοποιείται για τη μέτρηση της ποσότητας μιας ουσίας.
Μόριο: Το μόριο χρησιμοποιείται για την ονομασία ενός συνδυασμού πολλών ατόμων.
Μονάδες
Τυφλοπόντικα: Το mole δίνεται στη μονάδα "mol".
Μόριο: Ο αριθμός των μορίων μπορεί να μετρηθεί ως ο αριθμός των "mol" που υπάρχουν.
Συμπέρασμα
Αν και οι δύο όροι mole και molecules είναι διακριτοί όροι, η έννοια των mole μπορεί να χρησιμοποιηθεί για τη μέτρηση της ποσότητας των μορίων που υπάρχουν σε ένα δείγμα. Η κύρια διαφορά μεταξύ mole και μορίου είναι ότι το mole είναι μια μονάδα μέτρησης της ποσότητας ενώ το μόριο είναι ένα χημικό είδος που αποτελείται από άτομα.




