Διαφορά μεταξύ μονοβασικών διβασικών και τριβασικών οξέων
Κύρια διαφορά – Μονοβασικό vs Διβασικό vs Τριβασικά οξέα
Τα οξέα είναι χημικές ενώσεις που έχουν όξινες ιδιότητες. Ένα οξύ μπορεί επίσης να οριστεί ως ένα χημικό είδος που μπορεί να αντιδράσει με μια βάση σχηματίζοντας ένα άλας και νερό. Υπάρχουν δύο κύριοι τύποι οξέων, όπως τα ισχυρά οξέα και τα αδύναμα οξέα. Τα οξέα μπορούν επίσης να κατηγοριοποιηθούν σε τρεις ομάδες ως μονοβασικά οξέα, διβασικά οξέα και τριβασικά οξέα. Τα οξέα ομαδοποιούνται με τέτοιο τρόπο ανάλογα με τον αριθμό των πρωτονίων που έχουν για να αντιδράσουν με μια βάση. Τα διβασικά και τριβασικά οξέα μαζί ονομάζονται πολυβασικά οξέα. Αυτά τα μονοβασικά και πολυβασικά οξέα μπορεί να είναι είτε ισχυρά οξέα είτε ασθενή οξέα. Η κύρια διαφορά μεταξύ μονοβασικών διβασικών και τριβασικών οξέων είναι ότι ένα μονοβασικό οξύ έχει μόνο ένα αντικαταστάσιμο άτομο υδρογόνου και ένα διβασικό οξύ έχει δύο αντικαταστάσιμα άτομα υδρογόνου, ενώ ένα τριβασικό οξύ έχει τρία αντικαταστάσιμα άτομα υδρογόνου.
Βασικές περιοχές που καλύπτονται
1. Τι είναι τα μονοβασικά οξέα
– Ορισμός, διάσπαση και παραδείγματα
2. Τι είναι τα διβασικά οξέα
– Ορισμός, διάσπαση και παραδείγματα
3. Τι είναι τα τριβασικά οξέα
– Ορισμός, διάσπαση και παραδείγματα
4. Ποια είναι η διαφορά μεταξύ μονοβασικών διβασικών και τριβασικών οξέων
– Σύγκριση βασικών διαφορών
Βασικοί όροι:οξύ, διβασικά οξέα, μονοβασικό οξύ, αλάτι, τριβασικό οξύ

Τι είναι τα μονοβασικά οξέα
Τα μονοβασικά οξέα είναι όξινες ενώσεις που έχουν ένα αντικαταστάσιμο άτομο υδρογόνου ανά μόριο οξέος. Σε ένα υδατικό διάλυμα, αυτά τα οξέα μπορούν να αφαιρέσουν ένα πρωτόνιο (άτομο υδρογόνου). Επομένως, αυτά ονομάζονται μονοπρωτικά οξέα . Ένα μονοβασικό οξύ μπορεί να δώσει μόνο ένα άτομο υδρογόνου για την αντίδραση μεταξύ ενός μονοβασικού οξέος και μιας βάσης.
Δεδομένου ότι η διάσταση ενός μονοβασικού οξέος δίνει μόνο ένα άτομο υδρογόνου στο σύστημα, η εξίσωση για τη σταθερά διάστασης ενός μονοβασικού οξέος περιλαμβάνει τη συγκέντρωση μόνο ενός ιόντος Η. Η διάσταση ενός μονοβασικού οξέος μπορεί να παρουσιαστεί όπως παρακάτω.
HA(aq) → H(aq) + A(aq)
ή
HA(aq) + H2 O(l) → A(aq) + H3 O(aq)
Σταθερά διάστασης Ka = [H(aq) ][ A(aq) ] / [HA(aq) ] 
Εικόνα 1:Δομή του υδροχλωρικού οξέος (Το άτομο υδρογόνου εμφανίζεται με κόκκινο χρώμα)
Υπάρχουν οργανικά και ανόργανα μονοβασικά οξέα. Μερικά είναι ισχυρά οξέα ενώ άλλα είναι αδύναμα οξέα. Ισχυρά μονοβασικά οξέα όπως HCl, HNO3 , το HBr μπορεί να διαχωρίσει πλήρως και να δώσει ένα υδρογόνο σε μια βάση. Ασθενή μονοβασικά οξέα όπως το οξικό οξύ (CH3 COOH) διασπώνται μερικώς.
Τι είναι τα Διβασικά Οξέα
Τα διβασικά οξέα είναι χημικές ενώσεις που έχουν δύο αντικαταστάσιμα άτομα υδρογόνου ανά μόριο οξέος. Επομένως αυτά τα διβασικά οξέα μπορούν να δώσουν δύο άτομα υδρογόνου για την αντίδραση μεταξύ ενός διβασικού οξέος και μιας βάσης. Σε ένα υδατικό διάλυμα, τα διβασικά οξέα διασπώνται παρέχοντας δύο ιόντα υδρογόνου (Η) στο σύστημα. Επομένως, αυτά ονομάζονται επίσης διπρωτικά οξέα .
Η διάσταση ενός διβασικού οξέος μπορεί να δοθεί όπως παρακάτω. Ένα διβασικό οξύ έχει δύο σταθερές τιμές διάστασης. Αυτά είναι για την πρώτη διάσπαση και τη δεύτερη διάσπαση.
H2 B(aq) → 2H(aq) + B(aq)
ή
H2 B(aq) → H(aq) + HB(aq); Ka1
HB(aq) → H(aq) + B(aq); Ka2
Σταθερά διάστασης Ka1 = [H(aq) ][ HB(aq) ] / [H2 B(aq) ]
Σταθερά διάστασης Ka2 = [H(aq) ][ B(aq) ] / [HB(aq) ] 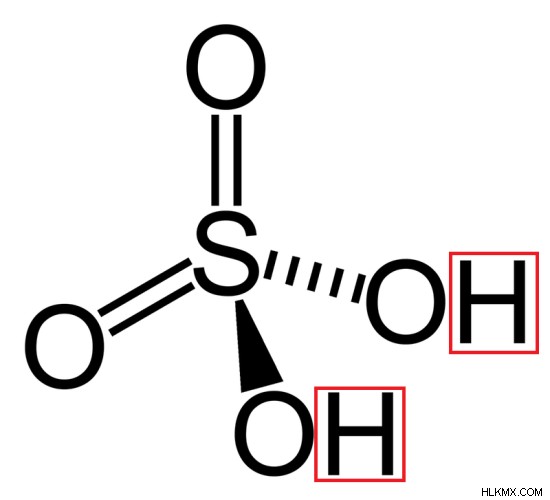
Εικόνα 2:Δομή θειικού οξέος (Δύο άτομα υδρογόνου φαίνονται με κόκκινο χρώμα)
Τα διβασικά οξέα μπορούν επίσης να βρεθούν σε δύο τύπους, όπως ισχυρά διβασικά οξέα και αδύναμα διβασικά οξέα. Τα ισχυρά διβασικά οξέα διασπώνται πλήρως σε δύο άτομα υδρογόνου και το συζευγμένο ιόν του οξέος. Ο πρώτος ιονισμός τους είναι ισχυρός. Όμως τα αδύναμα διβασικά οξέα διασπώνται μερικώς σε δύο άτομα υδρογόνου και στο συζευγμένο ιόν του οξέος. Μερικά κοινά παραδείγματα διβασικών οξέων περιλαμβάνουν το H2 SO4 , H2 CO3 και H2 C2 O4 .
Τι είναι τα Tribasic Acids
Τα τριβασικά οξέα είναι χημικές ενώσεις που έχουν τρία αντικαταστάσιμα άτομα υδρογόνου. Αυτά τα οξέα μπορούν να δώσουν τρία ιόντα υδρογόνου για την αντίδραση μεταξύ ενός τριβασικού οξέος και μιας βάσης. Δεδομένου ότι μπορούν να αφαιρέσουν τρία ιόντα Η (πρωτόνια), αυτά τα οξέα ονομάζονται επίσης τριπρωτικά οξέα .
Η διάσταση ενός τριβασικού οξέος παρέχει τρία ιόντα υδρογόνου στο σύστημα. Επομένως, η διάσταση ενός τριβασικού οξέος έχει τρεις σταθερές διάστασης.
H3 C(aq) → 3H(aq) + C(aq)
ή
H3 C(aq) → H(aq) + H2 C(aq); Ka1
H2 C(aq) → H(aq) + HC(aq); Ka2
HC(aq) → H(aq) + C(aq); Ka3
Σταθερά διάστασης, Ka1 = [H(aq) ][ H2 C(aq) ] / [H3 C(aq) ]
Σταθερά διάστασης, Ka2 = [H(aq) ][HC(aq) ] / [H2 C(aq) ]
Σταθερά διάστασης, Ka3 = [H(aq) ][ C(aq) ] / [HC(aq) ] 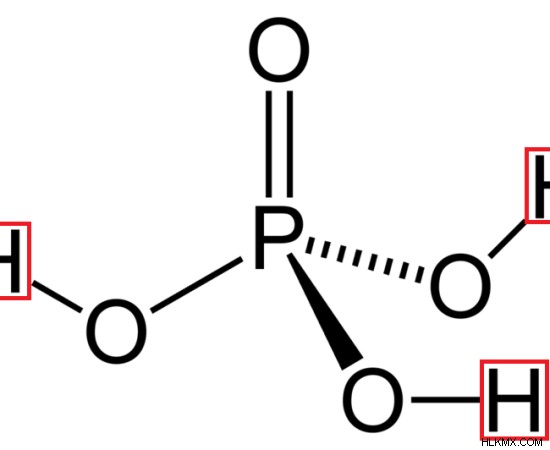
Εικόνα 3:Δομή του φωσφορικού οξέος (τρία άτομα υδρογόνου φαίνονται με κόκκινο χρώμα)
Ένα κοινό ανόργανο τριβασικό οξύ είναι το φωσφορικό οξύ (H3 PO4 ). Αποτελείται από τρία άτομα υδρογόνου συνδεδεμένα με τρία άτομα οξυγόνου γύρω από το άτομο φωσφόρου. Αυτά τα άτομα υδρογόνου μπορούν να αντικατασταθούν ή να αφαιρεθούν από το μόριο. Ένα κοινό οργανικό τριβασικό οξύ είναι το κιτρικό οξύ.
Διαφορά μεταξύ μονοβασικών διβασικών και τριβασικών οξέων
Ορισμός
Μονοβασικό οξύ: Τα μονοβασικά οξέα είναι όξινες ενώσεις που έχουν ένα αντικαταστάσιμο άτομο υδρογόνου ανά μόριο οξέος.
Διβασικό οξύ: Τα διβασικά οξέα είναι χημικές ενώσεις που έχουν δύο αντικαταστάσιμα άτομα υδρογόνου ανά μόριο οξέος.
Τριβασικό οξύ: Τα τριβασικά οξέα είναι χημικές ενώσεις που έχουν τρία αντικαταστάσιμα άτομα υδρογόνου ανά μόριο οξέος.
Ιόντα υδρογόνου που δωρίζονται για αντιδράσεις οξέος-βάσης
Μονοβασικό οξύ: Τα μονοβασικά οξέα μπορούν να δώσουν μόνο ένα ιόν υδρογόνου για μια αντίδραση οξέος-βάσης.
Διβασικό οξύ: Τα διβασικά οξέα μπορούν να δώσουν δύο ιόντα υδρογόνου για μια αντίδραση οξέος-βάσης.
Τριβασικό οξύ: Τα τριβασικά οξέα μπορούν να δώσουν τρία ιόντα υδρογόνου για μια αντίδραση οξέος-βάσης.
Διάσπαση
Μονοβασικό οξύ: Τα μονοβασικά οξέα δεν έχουν σταδιακή διάσταση.
Διβασικό οξύ: Τα διβασικά οξέα διαχωρίζονται σε δύο στάδια.
Τριβασικό οξύ: Τα τριβασικά οξέα διαχωρίζονται σε τρία στάδια.
Σταθερές διάσπασης
Μονοβασικό οξύ: Τα μονοβασικά οξέα έχουν μόνο μία σταθερά διάστασης.
Διβασικό οξύ: Τα διβασικά οξέα έχουν δύο σταθερές διάστασης.
Τριβασικό οξύ: Τα τριβασικά οξέα έχουν τρεις σταθερές διάστασης.
Συμπέρασμα
Τα οξέα είναι ενώσεις που μπορούν να απελευθερώσουν πρωτόνια (ή ιόντα Η) σε ένα σύστημα. Επομένως, η παρουσία ενός οξέος υποδεικνύεται από μια χαμηλή τιμή pH αυτού του συστήματος. Η οξύτητα ενός συστήματος εξαρτάται από τον τύπο του οξέος που υπάρχει σε αυτό το σύστημα. Τα οξέα κατηγοριοποιούνται κυρίως σε ισχυρά και αδύναμα οξέα. Σύμφωνα με τον αριθμό των πρωτονίων που δίνουν αυτά τα οξέα για μια αντίδραση οξέος-βάσης, τα οξέα μπορούν επίσης να ομαδοποιηθούν σε μονοβασικά οξέα και πολυβασικά οξέα. Τα διβασικά οξέα και τα τριβασικά οξέα είναι πολυβασικά οξέα. Η κύρια διαφορά μεταξύ μονοβασικών διβασικών και τριβασικών οξέων είναι ότι ένα μονοβασικό οξύ έχει μόνο ένα αντικαταστάσιμο άτομο υδρογόνου και τα διβασικά οξέα έχουν δύο αντικαταστάσιμα υδρογόνα, ενώ τα τριβασικά οξέα έχουν τρία αντικαταστάσιμα άτομα υδρογόνου.




