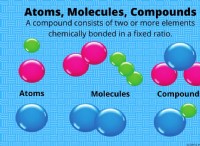
Σε μια ιοντική ένωση τα αξιοθέατα μεταξύ των κατιόντων και των ενώσεων συγκράτησης;
Για παράδειγμα, στο χλωριούχο νάτριο (NaCl), τα ιόντα νατρίου έχουν φορτίο +1 και τα ιόντα χλωριδίου έχουν φορτίο -1. Η απόσταση μεταξύ των ιόντων είναι σχετικά μικρή, οπότε η έλξη μεταξύ τους είναι ισχυρή. Αυτή η ισχυρή έλξη συγκρατεί μαζί την ένωση NaCl και το καθιστά ένα στερεό σε θερμοκρασία δωματίου.
Αντίθετα, στο ιωδιούχο κάλιο (KI), τα ιόντα καλίου έχουν φορτίο +1 και τα ιόντα ιωδιδίου έχουν χρέωση -1. Ωστόσο, η απόσταση μεταξύ των ιόντων στο ΚΙ είναι μεγαλύτερη από την απόσταση μεταξύ των ιόντων στο NaCl. Αυτό σημαίνει ότι η έλξη μεταξύ των ιόντων στο ΚΙ είναι ασθενέστερη από την έλξη μεταξύ των ιόντων στο NaCl. Ως αποτέλεσμα, το KI είναι υγρό σε θερμοκρασία δωματίου.
Επομένως, τα αξιοθέατα μεταξύ κατιόντων και ανιόντων συγκρατούν ιοντικές ενώσεις μαζί. Η δύναμη αυτών των αξιοθέατων εξαρτάται από τις χρεώσεις των ιόντων και την απόσταση μεταξύ τους. Όσο μεγαλύτερες είναι οι χρεώσεις των ιόντων και τόσο μικρότερη είναι η απόσταση μεταξύ τους, τόσο ισχυρότερη είναι η έλξη και όσο πιο σφιχτά η ένωση συγκρατείται μαζί.