Τι είναι τα γεγονότα χημικές αντιδράσεις;
Τι είναι:
* Αναδιάταξη ατόμων: Οι χημικές αντιδράσεις περιλαμβάνουν το σπάσιμο και τη διαμόρφωση χημικών δεσμών μεταξύ των ατόμων. Αυτό έχει ως αποτέλεσμα την αναδιάταξη των ατόμων για τη δημιουργία νέων ουσιών με διαφορετικές ιδιότητες.
* Αλλαγές ενέργειας: Οι χημικές αντιδράσεις περιλαμβάνουν αλλαγές ενέργειας. Ορισμένες αντιδράσεις απελευθερώνουν ενέργεια (εξωθερμικές αντιδράσεις) ενώ άλλες απαιτούν ενέργεια εισροής (ενδοθερμικές αντιδράσεις).
* Διατήρηση της μάζας: Σε μια χημική αντίδραση, η συνολική μάζα των αντιδραστηρίων (αρχικά υλικά) ισούται πάντα με τη συνολική μάζα των προϊόντων (σχηματίζονται ουσίες). Αυτό είναι γνωστό ως ο νόμος της διατήρησης της μάζας.
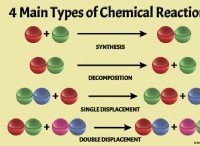
Τύποι αντιδράσεων:
* Αντιδράσεις σύνθεσης: Δύο ή περισσότερες ουσίες συνδυάζονται για να σχηματίσουν μια νέα ουσία. Παράδειγμα:2H₂ + O₂ → 2H₂O (σχηματισμός νερού)
* αντιδράσεις αποσύνθεσης: Μια ενιαία ουσία διασπάται σε δύο ή περισσότερες απλούστερες ουσίες. Παράδειγμα:2H₂O → 2H₂ + O₂ (ηλεκτρόλυση νερού)
* Αντιδράσεις μεμονωμένης μετατόπισης: Ένα στοιχείο αντικαθιστά ένα άλλο στοιχείο σε μια ένωση. Παράδειγμα:zn + cuso₄ → znso₄ + cu
* Αντιδράσεις διπλής μετατόπισης: Δύο ενώσεις ανταλλάσσουν ιόντα ή ομάδες ατόμων. Παράδειγμα:Agno₃ + NaCl → Agcl + Nano₃
* αντιδράσεις καύσης: Μια ουσία αντιδρά γρήγορα με το οξυγόνο, παράγοντας θερμότητα και φως. Παράδειγμα:ch₄ + 2o₂ → co₂ + 2h₂o
* Αντιδράσεις βάσης οξέος: Ένα οξύ αντιδρά με μια βάση για να σχηματίσει αλάτι και νερό. Παράδειγμα:HCL + NAOH → NACL + H₂O
Παράγοντες που επηρεάζουν τον ρυθμό αντίδρασης:
* Θερμοκρασία: Οι υψηλότερες θερμοκρασίες αυξάνουν γενικά τους ρυθμούς αντίδρασης επειδή τα μόρια κινούνται ταχύτερα, αυξάνοντας τη συχνότητα των συγκρούσεων.
* Συγκέντρωση: Οι υψηλότερες συγκεντρώσεις των αντιδραστηρίων οδηγούν σε περισσότερες συγκρούσεις, αυξάνοντας τον ρυθμό αντίδρασης.
* επιφάνεια: Η αύξηση της επιφάνειας ενός στερεού αντιδραστηρίου (π.χ. με λείανση του) εκθέτει περισσότερα μόρια σε συγκρούσεις, επιταχύνοντας την αντίδραση.
* Catalyst: Ένας καταλύτης επιταχύνει μια αντίδραση χωρίς να καταναλώνεται. Παρέχει μια εναλλακτική οδό αντίδρασης με χαμηλότερη ενέργεια ενεργοποίησης.
Άλλες σημαντικές σημειώσεις:
* Αναστρέψιμες αντιδράσεις: Ορισμένες αντιδράσεις μπορούν να προχωρήσουν και στις δύο κατευθύνσεις.
* Ισορροπία: Μια κατάσταση όπου τα ποσοστά των εμπρόσθιων και αντίστροφων αντιδράσεων είναι ίσοι.
* Ενέργεια ενεργοποίησης: Η ελάχιστη ενέργεια που απαιτείται για τα αντιδραστήρια να ξεκινήσουν μια χημική αντίδραση.
Επιτρέψτε μου να ξέρω αν θέλετε να μάθετε περισσότερα για έναν συγκεκριμένο τύπο χημικής αντίδρασης ή οποιαδήποτε άλλη πτυχή αυτού του θέματος!