Ένα άτομο λιθίου που έχει χάσει ένα ηλεκτρόνιο έρχεται κοντά σε ένα χλώριο που κέρδισε ηλεκτρόνιο. Τι συμβαίνει;
Ο σχηματισμός ενός ιοντικού δεσμού
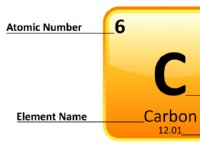
* λίθιο (li+) :Όταν ένα άτομο λιθίου χάνει ένα ηλεκτρόνιο, γίνεται ένα θετικά φορτισμένο ιόν (Li+). Αυτό οφείλεται στο γεγονός ότι τώρα έχει ένα λιγότερο ηλεκτρόνιο από τα πρωτόνια, δίνοντάς του μια καθαρή θετική χρέωση.
* χλώριο (cl-) :Όταν ένα άτομο χλωρίου κερδίζει ένα ηλεκτρόνιο, γίνεται ένα αρνητικά φορτισμένο ιόν (cl-). Έχει τώρα ένα ακόμη ηλεκτρόνιο από τα πρωτόνια, με αποτέλεσμα ένα καθαρό αρνητικό φορτίο.
* έλξη :Αντιθέτως, οι απέναντι χρεώσεις προσελκύουν! Το θετικά φορτισμένο ιόν λιθίου (Li+) θα προσελκύεται έντονα από το αρνητικά φορτισμένο ιόν χλωρίου (Cl-). Αυτή η ηλεκτροστατική έλξη σχηματίζει έναν ιοντικό δεσμό μεταξύ των δύο ιόντων.
Το αποτέλεσμα:χλωριούχο λιθίου (LICL)
Η ισχυρή έλξη μεταξύ των ιόντων λιθίου και χλωρίου δημιουργεί μια σταθερή ένωση που ονομάζεται χλωριούχο λιθίου (LICL). Αυτή η ένωση είναι ένα λευκό, κρυσταλλικό στερεό και χρησιμοποιείται συνήθως σε διάφορες εφαρμογές, συμπεριλαμβανομένων των μπαταριών και της χημικής σύνθεσης.
Βασικά σημεία:
* Ιονικά ομόλογα: Οι ιοντικοί δεσμοί σχηματίζονται από την ηλεκτροστατική έλξη μεταξύ των αντίθετα φορτισμένων ιόντων. Βρίσκονται συνήθως μεταξύ των μετάλλων και των μη μεταλλικών.
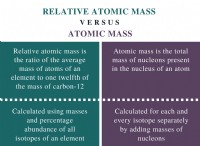
* σταθερότητα: Ο σχηματισμός ιοντικών δεσμών είναι ενεργειακά ευνοϊκός. Τα ιόντα γίνονται πιο σταθερά επιτυγχάνοντας ένα πλήρες εξωτερικό κέλυφος ηλεκτρονίων.
* Ηλεκτροργατιστικότητα: Η τάση ενός ατόμου να προσελκύει ηλεκτρόνια ονομάζεται ηλεκτροαρνητικότητα. Το χλώριο είναι πολύ πιο ηλεκτροαρνητικό από το λίθιο, εξηγώντας γιατί κερδίζει εύκολα ένα ηλεκτρόνιο, ενώ το λίθιο χάνει εύκολα ένα.
Επιτρέψτε μου να ξέρω αν θέλετε να εξηγήσω κάτι περισσότερο!