Διαφορά μεταξύ της σχετικής ατομικής μάζας και της ατομικής μάζας
Κύρια διαφορά – Σχετική ατομική μάζα έναντι ατομικής μάζας
Τα άτομα είναι οι βασικές μονάδες της ύλης. Επιστημονικές ανακαλύψεις έχουν αποκαλύψει ότι ένα άτομο μπορεί να χωριστεί περαιτέρω σε υποατομικά σωματίδια:ηλεκτρόνια, πρωτόνια και νετρόνια. Ανακαλύφθηκε επίσης ότι ένα άτομο έχει μια πολύπλοκη δομή με έναν κεντρικό πυρήνα, που ονομάζεται πυρήνας και ηλεκτρόνια που κινούνται γύρω από αυτόν τον πυρήνα. Ο πυρήνας περιέχει πρωτόνια και νετρόνια. Η σχετική ατομική μάζα και η ατομική μάζα είναι δύο χημικοί όροι που χρησιμοποιούνται για να εκφράσουν τη μάζα ενός ατόμου. Η κύρια διαφορά μεταξύ της σχετικής ατομικής μάζας και της ατομικής μάζας είναι ότι η σχετική ατομική μάζα είναι ο λόγος της μέσης μάζας των ατόμων ενός στοιχείου προς το ένα δωδέκατο της μάζας του άνθρακα-12, ενώ η ατομική μάζα είναι η συνολική μάζα των νουκλεονίων που υπάρχουν στον πυρήνα ενός ατόμου.
Βασικές περιοχές που καλύπτονται
1. Τι είναι η σχετική ατομική μάζα
– Ορισμός, Υπολογισμός, Παράδειγμα
2. Τι είναι η ατομική μάζα
– Ορισμός, Υπολογισμός, Παράδειγμα
3. Ποια είναι η διαφορά μεταξύ της σχετικής ατομικής μάζας και της ατομικής μάζας
– Σύγκριση βασικών διαφορών
Βασικοί όροι:Άτομο, ατομική μάζα, ηλεκτρόνια, νετρόνια, πυρήνας, πρωτόνια, σχετική ατομική μάζα

Τι είναι η σχετική ατομική μάζα
Η σχετική ατομική μάζα είναι ο λόγος της μέσης μάζας των ατόμων ενός στοιχείου προς το ένα δωδέκατο της μάζας του άνθρακα-12. Το ένα δωδέκατο της μάζας ενός ατόμου άνθρακα-12 ονομάζεται μονάδα ατομικής μάζας (1 amu ή 1 u). Ως εκ τούτου, η σχετική ατομική μάζα του άνθρακα-12 είναι 12 amu.
Σχετική ατομική μάζα =μέση μάζα ατόμου/μάζα άνθρακα-12 x (1/12)
Η μέση μάζα ενός ατόμου υπολογίζεται χρησιμοποιώντας τις μάζες διαφορετικών ισοτόπων ενός στοιχείου και την αφθονία τους. Η τιμή του ενός δωδέκατο της μάζας του ισοτόπου άνθρακα-12 είναι 1,66054 x 10 g. Είναι ίσο με 1 u ή μια ενοποιημένη μονάδα ατομικής μάζας. Ας εξετάσουμε ένα άτομο υδρογόνου και ας υπολογίσουμε τη σχετική ατομική μάζα.
Σχετική ατομική μάζα υδρογόνου
Αρχικά, πρέπει να βρούμε τη μέση μάζα ενός ατόμου υδρογόνου.
| Ισότοπο | Αφθονία (%) | Μάζα (u) |
| Hydrogen-1 | 99,98 | 1,007825 |
| Hydrogen-2 | 0,02 | 2.014101 |
| Hydrogen-3 | Trace | 3.016049 |
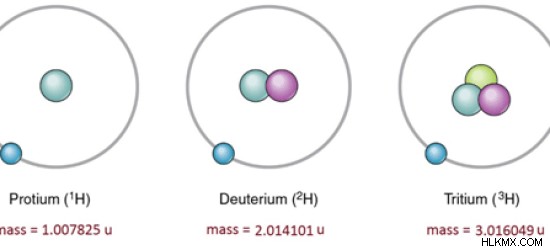
Εικόνα 1:Ισότοπα υδρογόνου
Μέση μάζα υδρογόνου =(1.007825 U x 99.98 %) + (2.014101 U x0.02 %)
=(1.007623 + 0.0000402) U
=1.0076632 U
Η τιμή του ενός δωδέκατου της μάζας του ισοτόπου άνθρακα-12 είναι 1 u.
Επομένως,
Σχετική ατομική μάζα =μέση μάζα ατόμου/μάζα άνθρακα-12 x (1/12)
Εδώ, η μάζα του τριτίου δεν συμπεριλήφθηκε στον υπολογισμό επειδή η αφθονία του είναι ίχνος στο περιβάλλον και είναι αμελητέα. Η τελική τιμή είναι αδιάστατη επειδή είναι σχετική τιμή.
Τι είναι η ατομική μάζα
Ατομική μάζα είναι η συνολική μάζα των νουκλεονίων που υπάρχουν στον πυρήνα ενός ατόμου. Ένα νουκλεόνιο είναι είτε πρωτόνιο είτε νετρόνιο. Ως εκ τούτου, η ατομική μάζα είναι η συνολική μάζα του πρωτονίου και των νετρονίων που υπάρχουν στον πυρήνα. Αν και τα ηλεκτρόνια υπάρχουν επίσης στα άτομα, η μάζα των ηλεκτρονίων δεν χρησιμοποιείται στους υπολογισμούς επειδή τα ηλεκτρόνια είναι τόσο μικρά και έχουν αμελητέα μάζα σε σύγκριση με τα πρωτόνια και τα νετρόνια.
Σε αντίθεση με τη σχετική ατομική μάζα, εδώ υπολογίζουμε τη μάζα κάθε ατόμου χωρίς να υπολογίζουμε καμία μέση τιμή. Επομένως, παίρνουμε διαφορετικές τιμές για ατομικές μάζες διαφορετικών ισοτόπων. Αυτό συμβαίνει επειδή ο αριθμός των νουκλεονίων που υπάρχουν στα ισότοπα του ίδιου στοιχείου είναι διαφορετικός μεταξύ τους.
Ας εξετάσουμε το ίδιο παράδειγμα με τη σχετική ατομική μάζα. υδρογόνο.
Ατομική μάζα υδρογόνου-2
Η ατομική μάζα του ισοτόπου υδρογόνου-2 (Δευτέριο) υπολογίζεται ως εξής.
Ο αριθμός των πρωτονίων στον πυρήνα =1
Ο αριθμός των νετρονίων στον πυρήνα =1
Ατομική μάζα υδρογόνου =1 amu)
. 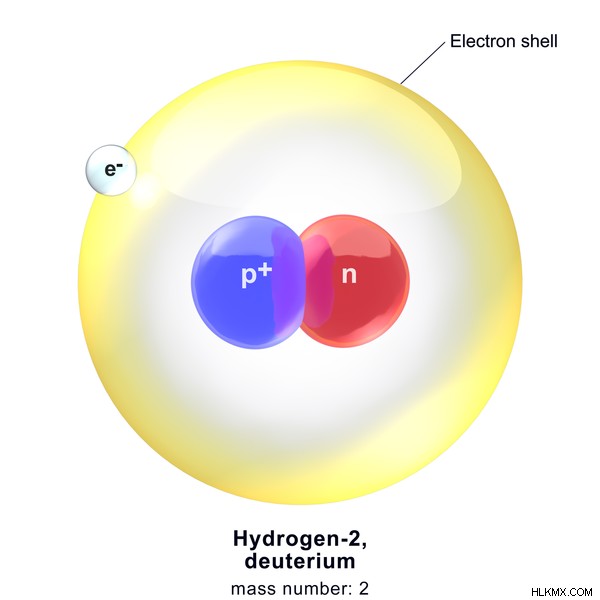
Εικόνα 2:Δομή του δευτερίου
Η ατομική μάζα δίνεται από τη μονάδα amu (μονάδες ατομικής μάζας). Ένα πρωτόνιο ή ένα νετρόνιο έχει μάζα 1 amu.
Διαφορά μεταξύ της σχετικής ατομικής μάζας και της ατομικής μάζας
Ορισμός
Σχετική ατομική μάζα: Η σχετική ατομική μάζα είναι η αναλογία μεταξύ της μέσης μάζας των ατόμων ενός στοιχείου προς το ένα δωδέκατο της μάζας του άνθρακα-12.
Ατομική μάζα: Η ατομική μάζα είναι η συνολική μάζα των νουκλεονίων που υπάρχουν στον πυρήνα ενός ατόμου.
Ισότοπα
Σχετική ατομική μάζα: Η σχετική ατομική μάζα υπολογίζεται χρησιμοποιώντας τις μάζες και την ποσοστιαία αφθονία όλων των ισοτόπων ενός στοιχείου.
Ατομική μάζα: Η ατομική μάζα υπολογίζεται για κάθε ισότοπο χωριστά προσθέτοντας μάζες νουκλεονίων.
Τιμή
Σχετική ατομική μάζα: Η τιμή της σχετικής ατομικής μάζας λαμβάνεται σε σχέση με το ένα δωδέκατο της μάζας του ατόμου άνθρακα-12.
Ατομική μάζα: Η τιμή της ατομικής μάζας είναι μια άμεσα υπολογισμένη τιμή (όχι σχετική τιμή).
Μονάδα
Σχετική ατομική μάζα: Η σχετική ατομική μάζα είναι αδιάστατη επειδή είναι σχετική τιμή.
Ατομική μάζα: Η ατομική μάζα δίνεται από τη μονάδα amu.
Συμπέρασμα
Η ατομική μάζα και η σχετική ατομική μάζα είναι δύο σημαντικοί χημικοί όροι. Αν και ακούγονται παρόμοια, οι έννοιες είναι διαφορετικές. Η κύρια διαφορά μεταξύ της σχετικής ατομικής μάζας και της ατομικής μάζας είναι ότι η σχετική ατομική μάζα είναι ο λόγος της μέσης μάζας των ατόμων ενός στοιχείου προς το ένα δωδέκατο της μάζας του άνθρακα-12, ενώ η ατομική μάζα είναι η συνολική μάζα των νουκλεονίων που υπάρχουν στον πυρήνα ενός ατόμου.




