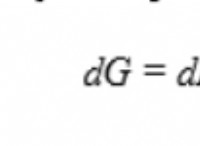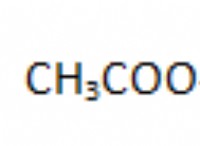Γιατί μια μη ισορροπημένη χημική εξίσωση δεν μπορεί να περιγράψει πλήρως μια αντίδραση;
1. Παραβίαση του νόμου της διατήρησης της μάζας:
* Η θεμελιώδης αρχή της χημείας δηλώνει ότι δεν μπορεί να δημιουργηθεί ή να καταστραφεί σε μια χημική αντίδραση.
* Μια μη ισορροπημένη εξίσωση υποδηλώνει ότι τα άτομα εξαφανίζονται ή εμφανίζονται από λεπτό αέρα, κάτι που είναι αδύνατο.
2. Λανθασμένη στοιχειομετρία:
* Η στοιχειομετρία είναι η μελέτη των ποσοτικών σχέσεων μεταξύ αντιδραστηρίων και προϊόντων σε χημικές αντιδράσεις.
* Μια μη ισορροπημένη εξίσωση δεν παρέχει πληροφορίες σχετικά με τις σχετικές ποσότητες αντιδραστηρίων και προϊόντων που εμπλέκονται στην αντίδραση. Αυτό καθιστά αδύνατο να προβλεφθεί η απόδοση μιας αντίδρασης ή να υπολογιστεί η ποσότητα των αντιδραστηρίων που απαιτούνται για μια συγκεκριμένη ποσότητα προϊόντος.
3. Ανακριβής αναπαράσταση της αντίδρασης:
* Μια ισορροπημένη εξίσωση αντικατοπτρίζει με ακρίβεια τον αριθμό των ατόμων κάθε στοιχείου και στις δύο πλευρές της εξίσωσης.
* Μια μη ισορροπημένη εξίσωση δεν αντιπροσωπεύει με ακρίβεια τις πραγματικές χημικές αλλαγές που συμβαίνουν κατά τη διάρκεια της αντίδρασης. Μπορεί να οδηγήσει σε παρεξήγηση του μηχανισμού αντίδρασης και των προϊόντων που σχηματίστηκαν.
4. Παραπλανητική ερμηνεία της αντίδρασης:
* Μια μη ισορροπημένη εξίσωση μπορεί να υποδηλώνει μια αντίδραση που δεν συμβαίνει στην πραγματικότητα ή να προβλέψει εσφαλμένα τα προϊόντα μιας αντίδρασης.
* Για παράδειγμα, μια μη ισορροπημένη εξίσωση μπορεί να υποδηλώνει ότι ένα μόνο αντιδραστήριο παράγει πολλαπλά προϊόντα όταν στην πραγματικότητα μπορεί να απαιτεί πολλαπλά αντιδραστήρια ή να παράγει ένα διαφορετικό σύνολο προϊόντων.
Συνοπτικά, μια ισορροπημένη χημική εξίσωση είναι ζωτικής σημασίας για:
* Ακριβής εκπροσώπηση: Αντικατοπτρίζει τις πραγματικές χημικές αλλαγές που λαμβάνουν χώρα.
* Διατήρηση της μάζας: Τηρεί τη θεμελιώδη αρχή της διατήρησης της μάζας.
* Προγνωστική δύναμη: Μας επιτρέπει να προβλέψουμε την ποσότητα των αντιδραστηρίων και των προϊόντων που εμπλέκονται.
* Κατανόηση της αντίδρασης: Παρέχει μια σαφή εικόνα των χημικών μετασχηματισμών.
Επομένως, μια μη ισορροπημένη εξίσωση είναι μια ελλιπής και δυνητικά παραπλανητική αναπαράσταση μιας χημικής αντίδρασης. Είναι απαραίτητο να εξισορροπήσουμε τις χημικές εξισώσεις να κατανοήσουμε πλήρως και να περιγράψουμε τις αντιδράσεις με ακρίβεια.