Παρασκευή Αλκανίων
Ένας από τους κύριους κλάδους της Χημείας είναι η οργανική χημεία, η οποία περιστρέφεται κυρίως γύρω από δομές, ιδιότητες και αντιδράσεις οργανικών ενώσεων με ομοιοπολικούς δεσμούς και άτομα άνθρακα.
Οι υδρογονάνθρακες είναι οργανικές ενώσεις που συνθέτουν δύο διαφορετικά είδη ατόμων, το υδρογόνο και τον άνθρακα. Αυτές οι ενώσεις είναι γενικά άχρωμες και έχουν αδύναμη οσμή. Οι αρχαίοι χημικοί περιγράφουν τους υδρογονάνθρακες είτε ως αρωματικούς είτε ως αλειφατικούς. Υπάρχουν διάφοροι τρόποι με τους οποίους μπορούμε να παρασκευάσουμε υδρογονάνθρακες.
Τι είναι οι υδρογονάνθρακες;
Όπως αναφέρθηκε προηγουμένως, οι υδρογονάνθρακες είναι οργανικές ενώσεις που αποτελούνται από βασικά άτομα που ονομάζονται υδρογόνο και άνθρακες. Γενικά, αυτά είναι άχρωμα αέρια με σχεδόν καθόλου οσμή.
Με βάση τους τύπους τους, οι υδρογονάνθρακες μπορεί να έχουν απλές ή πολύπλοκες δομές. Στην καθημερινή ζωή, οι υδρογονάνθρακες διαδραματίζουν σημαντικό ρόλο και η μελέτη τους παρέχει μια βαθιά εικόνα των ιδιοτήτων και της προετοιμασίας των λειτουργικών τους ομάδων.
Μπορούμε να χωρίσουμε τους υδρογονάνθρακες σε έξι κατηγορίες. Αυτά περιλαμβάνουν κορεσμένους υδρογονάνθρακες, ακόρεστους υδρογονάνθρακες, κυκλοαλκάνια, αρωματικούς υδρογονάνθρακες, αλειφατικούς υδρογονάνθρακες και αλεικυκλικούς υδρογονάνθρακες.
Τι είναι τα αλκάνια;
Μπορούμε να περιγράψουμε τα αλκάνια ως οργανικές ενώσεις που διαθέτουν μονάδες υδρογόνου και άνθρακα μονού δεσμού. Το CnH2n+2 είναι ο τύπος των Αλκανίων.
Μπορούμε να χωρίσουμε περαιτέρω τα αλκάνια σε τρεις μεγάλες ομάδες:κυκλοαλκάνια, διακλαδισμένα αλκάνια και αλκάνια αλυσίδας.
Παρασκευή αλκανίων
Τα αλκάνια είναι κορεσμένοι υδρογονάνθρακες. Τα άτομα άνθρακα τους συνδέονται στενά με διαφορετικά σύνολα ατόμων άνθρακα μόνο με δεσμούς σίγμα.
Στα αλκάνια, τα πρώτα τέσσερα μέλη, ξεκινώντας από το C1 έως το C4, είναι αέρια και από το C5 έως το C17, είναι υγρά. Αντίθετα, αυτά που έχουν 18 και πάνω από αυτά είναι στερεά.
Δεν έχουν χρώμα ή οσμή και παρασκευάζονται σε πολλές βιομηχανίες χρησιμοποιώντας διαφορετικές τεχνικές.
Παρασκευή αλκανίων από τον ακόρεστο υδρογονάνθρακα
Ας δούμε τις διάφορες μεθόδους παρασκευής αλκανίων:-
Από Αλκένια και Αλκίνια
Χρησιμοποιούμε μια διαδικασία που ονομάζεται υδρογόνωση για την παρασκευή αλκανίων από αλκένιο και αλκίνιο. Το αέριο διυδρογόνο αναμιγνύεται με αλκίνια και αλκένια σε έναν καταλύτη, όπως το παλλάδιο και το νικέλιο, για να σχηματιστούν αλκάνια.
Παρουσία νικελίου, η αντίδραση λαμβάνει χώρα σε αυξημένη θερμοκρασία. Ενώ, στην περίπτωση του παλλαδίου, η αντίδραση λαμβάνει χώρα σε θερμοκρασία δωματίου.
Παρασκευή αλκανίων από αλκυλαλογονίδια
Υπάρχουν δύο τρόποι παρασκευής αλκανίων μέσω αλκυλαλογονιδίων. Είναι οι εξής:
Όλα τα αλκάνια, εξαιρουμένων των φθοριδίων, παρασκευάζονται από το αλκυλαλογονίδιο μέσω αραιού υδροχλωρικού οξέος και αναγωγής ψευδαργύρου.
CH3Cl + H2 (Zn,H+)→ CH4 +HCl
Μια άλλη μέθοδος παρασκευής αλκανίων μέσω αλκυλαλογονιδίων ονομάζεται αντίδραση Wurtz. Όταν επεξεργαζόμαστε αλκυλαλογονίδια με μέταλλο νάτριο στον ξηρό αιθέρα, η παραγωγή αλκανίων είναι υψηλότερη. Με ζυγούς αριθμούς άνθρακα, η αντίδραση μπορεί να επιτύχει υψηλότερα αλκάνια.
Ακολουθεί η χημική εξίσωση για το ίδιο:
CH3-Br + 2Na + BrCH3 → CH3-CH3 + 2NaBr.
Παρασκευή αλκανίων από καρβοξυλικά οξέα
Μπορούμε να παρασκευάσουμε αλκάνια από καρβοξυλικό οξύ με δύο τρόπους ως εξής:
Πρέπει να αφαιρέσουμε το διοξείδιο του άνθρακα από το καρβοξυλικό οξύ για να παρασκευάσουμε αλκάνια. Αυτή η διαδικασία ονομάζεται αποκαρβοξυλίωση. Το παραγόμενο αλκάνιο έχει λιγότερη ποσότητα ατόμων άνθρακα που υπάρχουν στο καρβοξυλικό οξύ.
Ακολουθεί η χημική εξίσωση για το ίδιο:
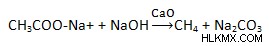
Η ηλεκτρολυτική μέθοδος του Kolbe χρησιμοποιεί την ηλεκτρόλυση αλάτων καλίου του καρβοξυλικού οξέος νατρίου για την παραγωγή αλκανίου. Αυτή η αντίδραση πήρε το όνομά της από τους Rudolf Schmitt και Hermann Kolbe.
Ακολουθεί η χημική εξίσωση για το ίδιο:
2CH3COO–Na+ + 2H2O → CH3 –Ch3 + 2CO2 + H2 + 2NaOH .
Οξεικό νάτριο
Μείωση του Clemmensen
Η αναγωγή του Clemmensen είναι η αντίδραση που χρησιμοποιείται για την αναγωγή κετονών ή αλδεϋδων στα αλκάνια χρησιμοποιώντας αμάλγαμα ψευδαργύρου και υδροχλωρικό οξύ. Το όνομα αυτής της αντίδρασης προήλθε από τον Erik Christian Clemmensen, έναν Δανό χημικό.

Συμπέρασμα
Οι υδρογονάνθρακες είναι οργανικές ενώσεις που αποτελούνται από βασικά άτομα που ονομάζονται υδρογόνο και άνθρακες. Από την άλλη πλευρά, τα αλκάνια είναι οργανικές ενώσεις που διαθέτουν ενώσεις υδρογόνου και άνθρακα μονού δεσμού και έχουν τον χημικό τύπο CnH2n+2. Επιπλέον, μπορούμε να διαιρέσουμε τα αλκάνια και τα κυκλοαλκάνια, τα διακλαδισμένα αλκάνια και τα αλκάνια αλυσίδας. Εδώ, συζητήσαμε την παρασκευή υδρογονανθράκων – αλκανίων.
Μπορούμε να παρασκευάσουμε αλκάνια από αλκένιο και αλκύνιο μέσω υδρογόνωσης. Υπάρχουν δύο τρόποι παρασκευής αλκανίων μέσω αλκυλαλογονιδίων. Πρώτον, μέσω αναγωγής με αραιό υδροχλωρικό οξύ και ψευδάργυρο. Μια άλλη ονομάζεται αντίδραση Wurtz. Συζητήσαμε επίσης την παρασκευή αλκανίων από καρβοξυλικά οξέα και εξηγήσαμε εν συντομία την Αναγωγή του Clemmensen.




