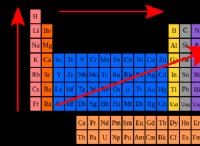
Είναι οι περισσότερες ενώσεις υδροξειδίου διαλυτό στο νερό;
Εδώ είναι γιατί:
* Ομάδα 1 Υδροξείδια (Lioh, Naoh, Koh, Rboh, CSOH): Αυτά είναι εξαιρετικά διαλυτά λόγω των ισχυρών ιοντικών δεσμών μεταξύ των αλκαλικών μετάλλων και του ιόντος υδροξειδίου.
* Ομάδα 2 υδροξείδια (CA (OH) 2, Sr (OH) 2, BA (OH) 2): Αυτά είναι μέτρια διαλυτά, με την αύξηση της διαλυτότητας κάτω από την ομάδα.
* Άλλα υδροξείδια: Η πλειονότητα των υδροξειδίων που σχηματίζονται με μεταβατικά μέταλλα και μη μέταλλα είναι αδιάλυτα στο νερό. Αυτό οφείλεται στο γεγονός ότι ο δεσμός μεταξύ του μεταλλικού κατιόντος και του ανιόντος του υδροξειδίου είναι συχνά ισχυρότερος από την έλξη μεταξύ των ιόντων και των μορίων νερού.
Εξαιρέσεις:
* υδροξείδιο αμμωνίου (NH4OH): Ενώ τεχνικά μια αδύναμη βάση, είναι εξαιρετικά διαλυτή στο νερό, σχηματίζοντας εύκολα ιόντα αμμωνίου (NH4+) και ιόντα υδροξειδίου (OH-).
Key Takeaway: Ενώ ορισμένα υδροξείδια είναι εξαιρετικά διαλυτά, πολλά δεν είναι. Γενικά, τα υδροξείδια γίνονται πιο διαλυτά καθώς μετακινείτε τον περιοδικό πίνακα στις ομάδες 1 και 2.