Τι είναι η συγγένεια ηλεκτρονίων;
Βασικές έννοιες
Σε αυτό το σεμινάριο σχετικά με τη συγγένεια ηλεκτρονίων, θα καλύψουμε τον ορισμό της, τις σχετικές τάσεις του περιοδικού πίνακα και τους παράγοντες που την επηρεάζουν.
Θέματα που καλύπτονται σε άλλα άρθρα
- Ηλεκτραρνητικότητα
- Ενέργεια ιονισμού
- Τάσεις του περιοδικού πίνακα
- Ενέργεια πλέγματος
- Τροχιακά ηλεκτρονίων και σχήματα τροχιών
Τι είναι η συγγένεια ηλεκτρονίων;
Οι χημικοί ορίζουν τη συγγένεια ηλεκτρονίων ως τη μεταβολή της ενέργειας, μετρούμενη σε μονάδες kJ/mole, που παρατηρείται όταν ένα ηλεκτρόνιο προστίθεται σε ένα αέριο άτομο. Αυτή η διαδικασία δημιουργεί ένα αρνητικό ιόν. Αυτή η διαδικασία διαφέρει από την ηλεκτραρνητικότητα, την οποία ορίζουμε ως την ικανότητα ενός ατόμου να έλκει ένα ηλεκτρόνιο προς τον εαυτό του.
Τείνουμε να παρομοιάζουμε τη συγγένεια των ηλεκτρονίων με την «πιθανότητα» ή την «πιθανότητα» ενός ατόμου να αποκτήσει ένα ηλεκτρόνιο. Είναι το αντίθετο της ενέργειας ιοντισμού, η ενέργεια που απαιτείται για να ιονιστεί ένα αέριο άτομο και κατά συνέπεια να αφαιρεθεί ένα ηλεκτρόνιο. Ουσιαστικά, η συγγένεια ηλεκτρονίων αφορά τις ενεργειακές μεταβολές που συνοδεύουν το κέρδος ενός ηλεκτρονίου και η ενέργεια ιονισμού σε αυτές που συνοδεύουν την απώλεια ενός ηλεκτρονίου. Οι ενέργειες ιονισμού περιλαμβάνουν πάντα το σχηματισμό θετικών ιόντων, οι ενέργειες συγγένειας ηλεκτρονίων περιγράφουν τη δημιουργία αρνητικών ιόντων.
Συγγένειες πρώτου και δεύτερου ηλεκτρονίου
Υπάρχουν δύο τύποι συγγένειας ηλεκτρονίων, ο πρώτος και ο δεύτερος. Το πρώτο περιλαμβάνει την προσθήκη ενός ηλεκτρονίου σε ένα ουδέτερο άτομο . Επειδή αυτή η εξώθερμη διαδικασία απελευθερώνει ενέργεια, οι συγγένειες των πρώτων ηλεκτρονίων είναι αρνητικές τιμές.
Το δεύτερο αφορά την προσθήκη ενός ηλεκτρονίου σε ένα αρνητικό ιόν . Αυτή η ενδόθερμη διαδικασία απαιτεί περισσότερη ενέργεια από αυτή που απελευθερώνεται όταν προστίθεται ένα ηλεκτρόνιο στο σύστημα. Αυτό έχει ως αποτέλεσμα θετικές τιμές συγγένειας δεύτερου ηλεκτρονίου.
Περιοδικές Τάσεις
Σε όλες τις περιόδους
Καθώς ταξιδεύουμε από αριστερά προς τα δεξιά στον περιοδικό πίνακα, οι συγγένειες ηλεκτρονίων γίνονται πιο θετικές - που σημαίνει ότι η διαδικασία προσκόλλησης ηλεκτρονίων είναι πιο εξώθερμη. Οι επιστήμονες αποδίδουν αυτό το μοτίβο στην προσθήκη ηλεκτρονίων πιο κοντά στους πυρήνες αυτών των πιο δεξιών ατόμων.
Καθώς τα στοιχεία τείνουν προς τα δεξιά, τα προστιθέμενα ηλεκτρόνια κάθονται πιο κοντά στους πυρήνες τους. Αυτά τα ηλεκτρόνια παρουσιάζουν ισχυρότερη έλξη προς τους πυρήνες ως αποτέλεσμα αυτής της εγγύτητας, εξηγώντας την εξώθερμη φύση των συγγένειών τους με τα ηλεκτρόνια.
Κάτω ομάδες
Καθώς ταξιδεύουμε προς τις ομάδες, οι συγγένειες ηλεκτρονίων γίνονται πιο αρνητικές, που σημαίνει ότι η διαδικασία είναι πιο ενδόθερμη. Η εγγύτητα των ηλεκτρονίων με αυτούς τους αντίστοιχους πυρήνες επηρεάζει επίσης αυτό το φαινόμενο, αλλά αντίθετα με την προηγούμενη τάση, τα ηλεκτρόνια τοποθετούνται σε υψηλότερα ενεργειακά επίπεδα. Καθώς ταξιδεύουμε σε μια ομάδα, τα στοιχεία περιέχουν ηλεκτρόνια πιο μακριά από τους πυρήνες τους και αυτά τα ηλεκτρόνια είναι συνδεδεμένα λιγότερο σφιχτά.
Τα χαλαρά συνδεδεμένα ηλεκτρόνια δεν απελευθερώνουν τόση ενέργεια κατά την ένωση ενός ατόμου σε σύγκριση με τα στενά συνδεδεμένα αντίστοιχά τους. Στοιχεία χαμηλότερα στον περιοδικό πίνακα αποβάλλουν λιγότερη ενέργεια με την προσθήκη ενός επιπλέον ηλεκτρονίου, δίνοντας τη μειωμένη εξώθερμη φύση των ηλεκτρονιακών συγγένειών τους.
Σύνοψη της τάσης
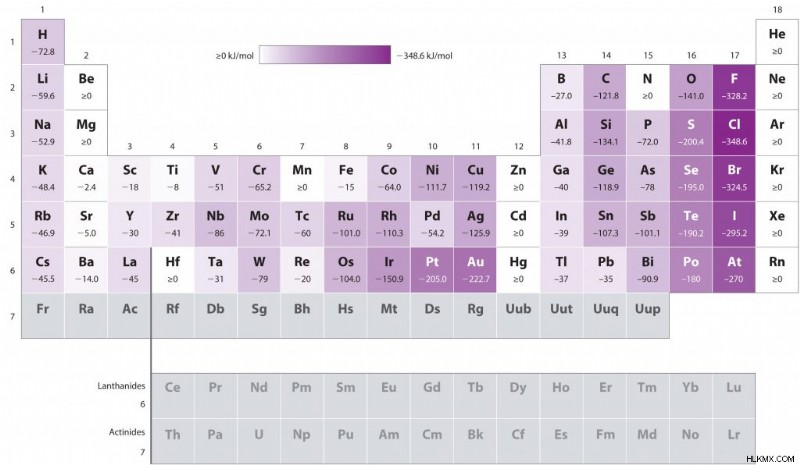
Παρακάτω είναι μια οπτική αναπαράσταση των τάσεων συγγένειας ηλεκτρονίων σε όλο τον περιοδικό πίνακα. Όπως συζητήθηκε, οι συγγένειες ηλεκτρονίων αυξάνονται από αριστερά προς τα δεξιά κατά τις περιόδους. Οι συγγένειες ηλεκτρονίων μειώνονται από τις ομάδες πάνω προς τα κάτω προς τα κάτω.
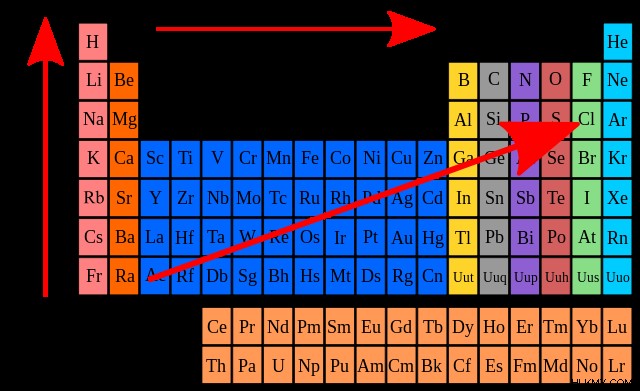
Εφέ θωράκισης
Ας εξετάσουμε πώς τα ηλεκτρόνια σθένους επηρεάζουν τις τάσεις συγγένειας ηλεκτρονίων. Ο αριθμός των ηλεκτρονίων σθένους αυξάνεται καθώς μετακινούμαστε προς τις ομάδες στον περιοδικό πίνακα, καθώς μειώνεται η συγγένεια των ηλεκτρονίων. Μπορούμε να το εκλογικεύσουμε αυτό λαμβάνοντας υπόψη το φαινόμενο θωράκισης . Αυτός ο κανόνας αναγνωρίζει ότι ενώ οι πυρήνες έλκουν ηλεκτρόνια σθένους, οι δυνάμεις απώθησης αντισταθμίζουν αυτήν την έλξη. Αυτές οι δυνάμεις απώθησης δημιουργούνται από εσωτερικά ηλεκτρόνια που βρίσκονται μεταξύ των πυρήνων και των εξωτερικών ηλεκτρονίων.
Καθώς ταξιδεύουμε κάτω από κάθε ομάδα, η επίδραση του φαινομένου θωράκισης αυξάνεται. Υπάρχει μια μείωση στην έλξη μεταξύ των εξωτερικών ηλεκτρονίων και των αντίστοιχων πυρήνων τους, παράγοντας στοιχεία με λιγότερη συγγένεια ηλεκτρονίων.
Εξαίρεση φθορίου
Το φθόριο παρουσιάζει μια άλλη προειδοποίηση σχετικά με την τάση συγγένειας των ομαδικών ηλεκτρονίων. Αν και οι συγγένειες των πρώτων ηλεκτρονίων γενικά μειώνονται καθώς ταξιδεύουμε σε μια ομάδα, που αντιστοιχεί σε λιγότερη ενεργειακή συμμετοχή στο σχηματισμό αρνητικών ιόντων, τα άτομα φθορίου σπάζουν αυτό το μοτίβο.
Δεδομένης της θέσης του στην κορυφή της αντίστοιχης ομάδας του, θα περίμενε κανείς ότι το φθόριο θα παρουσιάζει μια σχετικά υψηλή συγγένεια ηλεκτρονίων. Λόγω της πολύ μικρής ατομικής ακτίνας του φθορίου, ο χώρος που περιβάλλει τον πυρήνα του είναι επίσης πολύ μικρός, αυξάνοντας έτσι την έλξη μεταξύ του εισερχόμενου ηλεκτρονίου και του πυρήνα του φθορίου—και, κατ' επέκταση, τη συγγένεια των ηλεκτρονίων του.
Ωστόσο, πρέπει να έχουμε κατά νου ότι το εισερχόμενο ηλεκτρόνιο θα εισέρχεται σε μια πολυσύχναστη περιοχή που έχει ήδη επηρεαστεί από υψηλά επίπεδα απώθησης. Όπως είπαμε, η απώθηση μειώνει την έλξη μεταξύ των ηλεκτρονίων και του πυρήνα, μειώνοντας κατά συνέπεια τη συγγένεια των ηλεκτρονίων. Αυτά τα φαινόμενα απώθησης είναι ισχυρά στα άτομα φθορίου, ωθώντας τα να εμφανίζουν μικρότερες από τις αναμενόμενες συγγένειες ηλεκτρονίων.
Μέταλλα εναντίον Αμέταλλα
Γενικά, τα μέταλλα έχουν χαμηλότερες συγγένειες ηλεκτρονίων ενώ τα αμέταλλα έχουν υψηλότερες.
Μέταλλα
Τα μέταλλα θέλουν να σχηματίσουν σταθερές οκτάδες μέσω του σχηματισμού κατιόντων. Για να το πετύχουν αυτό, τείνουν να εγκαταλείψουν τα ηλεκτρόνια σθένους. Απορροφούν ενέργεια όταν χάνουν ηλεκτρόνια, συμβάλλοντας σε χαμηλότερες και ενδόθερμες συγγένειες.
Μη μέταλλα
Αντίθετα, στα αμέταλλα αρέσει να αποκτούν ηλεκτρόνια για να σχηματίσουν ανιόντα καθώς επιδιώκουν μια πλήρη οκτάδα. Απελευθερώνουν ενέργεια όταν προσλαμβάνουν ηλεκτρόνια, παράγοντας υψηλότερες και εξώθερμες συγγένειες ηλεκτρονίων.
Τι επηρεάζει τη συγγένεια ηλεκτρονίων ενός ατόμου;
Για άλλη μια φορά, όταν μιλάμε για συγγένεια ηλεκτρονίων, αναφερόμαστε στην αλλαγή στην ενέργεια που βιώνει ένα άτομο όταν αποκτά ένα ηλεκτρόνιο. Αυτή η διαδικασία αντανακλά την ποσότητα έλξης μεταξύ αυτού του εισερχόμενου ηλεκτρονίου και του πυρήνα του εμπλεκόμενου ατόμου. Όσο ισχυρότερη είναι η έλξη, τόσο περισσότερη ενέργεια απελευθερώνεται—και τόσο μεγαλύτερη θα είναι η συγγένεια των ηλεκτρονίων.
Οι δύο κύριοι παράγοντες που επηρεάζουν αυτές τις τάσεις, όπως φαίνεται στα παραδείγματά μας, περιλαμβάνουν το ατομικό μέγεθος και το πυρηνικό φορτίο. Οι πυρήνες που διαθέτουν μεγαλύτερο θετικό φορτίο προσελκύουν ηλεκτρόνια πιο έντονα, με αποτέλεσμα μεγαλύτερες συγγένειες ηλεκτρονίων. Αντίθετα, λιγότερο θετικά πυρηνικά φορτία διευκολύνουν μικρότερες συγγένειες ηλεκτρονίων.
Όσον αφορά το ατομικό μέγεθος, τα μικρότερα άτομα προσφέρουν λιγότερο χώρο για τη συλλογή ηλεκτρονίων, συμπεριλαμβανομένου του εισερχόμενου ηλεκτρονίου. Ως αποτέλεσμα, αυτό το επιπλέον ηλεκτρόνιο θα τοποθετηθεί πιο κοντά στον πυρήνα από ότι σε ένα μεγαλύτερο άτομο. Αυτό έχει ως αποτέλεσμα μεγαλύτερες τιμές συγγένειας ηλεκτρονίων για μικρότερα άτομα ως αποτέλεσμα της αυξημένης έλξης μεταξύ αυτού του εισερχόμενου ηλεκτρονίου και του πυρήνα. Από την άλλη πλευρά, τα μεγαλύτερα άτομα τείνουν να εμφανίζουν μικρότερες συγγένειες ηλεκτρονίων επειδή προσφέρουν περισσότερο χώρο για να μοιραστούν τα ηλεκτρόνια με τον εαυτό τους καθώς και με το εισερχόμενο ηλεκτρόνιο.
Αλλά δεν πρέπει να υποτιμούμε τις επιπτώσεις της απώθησης και της θωράκισης στη συγγένεια των ηλεκτρονίων. Για παράδειγμα, τα μικρότερα άτομα μπορεί να παρουσιάζουν μεγαλύτερη έλξη και μεγαλύτερες συγγένειες ηλεκτρονίων, αλλά η έλλειψη χώρου για τη συλλογή ηλεκτρονίων προκαλεί επίσης αυξημένη απώθηση μεταξύ αυτών των σωματιδίων. Η απώθηση μειώνει την έλξη μεταξύ του εισερχόμενου ηλεκτρονίου και του πυρήνα, διευκολύνοντας τις μειωμένες συγγένειες ηλεκτρονίων. Το εφέ θωράκισης δρα παρόμοια.
Πρέπει να εξετάσουμε κάθε έναν από αυτούς τους παράγοντες προσεκτικά, καθώς τα αποτελέσματά τους θα ποικίλλουν ανάλογα με τα χαρακτηριστικά κάθε στοιχείου. Η διερεύνηση των παρακάτω ερωτήσεων θα δώσει ένα παράδειγμα αυτής της ανάλυσης.
Ποιο στοιχείο έχει τη χαμηλότερη συγγένεια ηλεκτρονίων;
Ο υδράργυρος έχει τη χαμηλότερη συγγένεια ηλεκτρονίων μεταξύ των στοιχείων. Αυτή η ιδιότητα μπορεί να αποδοθεί στην οριοθέτησή του ως μέταλλο. Τα μέταλλα είναι, γενικά, πιο πιθανό να χάσουν ηλεκτρόνια παρά να τα αποκτήσουν στην επιδίωξή τους για μια πλήρη, σταθερή οκτάδα. Ο υδράργυρος έχει σχετικά μεγάλη ατομική ακτίνα, η οποία συμβάλλει επίσης στη χαμηλή τιμή του.
Ποιο στοιχείο έχει την υψηλότερη συγγένεια ηλεκτρονίων;
Το χλώριο έχει την υψηλότερη συγγένεια ηλεκτρονίων μεταξύ των στοιχείων. Η υψηλή του συγγένεια μπορεί να αποδοθεί στη μεγάλη ατομική ακτίνα ή το μέγεθός του. Επειδή το εξώτατο τροχιακό του χλωρίου είναι 3p, τα ηλεκτρόνια του έχουν μεγάλο χώρο για να μοιραστούν με ένα εισερχόμενο ηλεκτρόνιο. Αυτό ελαχιστοποιεί τις απωθήσεις μεταξύ αυτών των σωματιδίων σε βαθμό που αντισταθμίζει τις αρνητικές επιπτώσεις του μεγάλου μεγέθους του στην έλξη.
Ηλεκτρόνιο Γράφημα συγγένειας