Ποια είναι η διαφορά μεταξύ θετικών ιόντων και αρνητικών ιόντων;
* θετικά ιόντα (κατιόντα) έχουν χαθεί ένα ή περισσότερα ηλεκτρόνια, δίνοντάς τους μια καθαρή θετική χρέωση. Προσελκύονται από το αρνητικό ηλεκτρόδιο (κάθοδος).
* Αρνητικά ιόντα (Anions) έχουν κερδίσει ένα ή περισσότερα ηλεκτρόνια, δίνοντάς τους καθαρό αρνητικό φορτίο. Προσελκύονται από το θετικό ηλεκτρόδιο (άνοδο).
Εδώ είναι μια απλή αναλογία:Φανταστείτε ένα άτομο ως ουδέτερο αντικείμενο. Εάν χάσει ένα ηλεκτρόνιο, γίνεται σαν ένα μπαλόνι που τρίβεται στα μαλλιά σας, καθιστώντας το θετικά φορτισμένο. Εάν κερδίσει ένα ηλεκτρόνιο, είναι σαν ένα μπαλόνι που τρίβεται σε ένα πουλόβερ από μαλλί, καθιστώντας το αρνητικά φορτισμένο.
Εδώ είναι ένας πίνακας που συνοψίζει τις βασικές διαφορές:
| Χαρακτηριστικό | Θετικό ιόν (κατιόν) Αρνητικό ιόν (ανιόν) |
| --- | --- | --- |
| Χρέωση | Θετικό (+) | Αρνητικό (-) |
| Κέρδος/απώλεια ηλεκτρονίων | Χαμένα ηλεκτρόνια | Κέρδισαν ηλεκτρόνια |
| Προσελκύεται από | Κάθοδος (αρνητικό ηλεκτρόδιο) Άνοδο (θετικό ηλεκτρόδιο)
| Παραδείγματα | Ιόν νατρίου (Na+), ιόν ασβεστίου (Ca2+) | Ιόν Χλωριδίου (CL-), ιόν οξειδίου (Ο2-) |
Γιατί τα άτομα γίνονται ιόντα;
Τα άτομα γίνονται ιόντα για την επίτευξη σταθερής διαμόρφωσης ηλεκτρονίων. Αυτό οφείλεται στο γεγονός ότι τα άτομα είναι πιο σταθερά όταν το εξωτερικό τους κέλυφος (κέλυφος σθένους) γεμίζει με ηλεκτρόνια. Με την απόκτηση ή την απώλεια ηλεκτρονίων, μπορούν να επιτύχουν ένα πλήρες κέλυφος σθένους, το οποίο είναι μια πιο σταθερή κατάσταση.
Παραδείγματα ιόντων στην καθημερινή ζωή:
* Πίνακας αλάτι (NaCl) :Νάτριο (Na+) και χλωριούχο (cl-) ιόντα.
* ηλεκτρολύτες σε αθλητικά ποτά :Κοίριο (Κ+), μαγνήσιο (Mg2+), ασβέστιο (Ca2+) και ιόντα νατρίου (Na+).
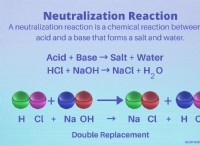
* Υδροχλωρικό οξύ (HCl) :Υδρογόνο (Η+) και ιόντα χλωριούχου (Cl-).
* μπαταρίες :Τα ιόντα ρέουν μέσω του διαλύματος ηλεκτρολύτη, δημιουργώντας ηλεκτρική ενέργεια.
Η κατανόηση της διαφοράς μεταξύ θετικών και αρνητικών ιόντων είναι απαραίτητη για την κατανόηση διαφόρων χημικών και βιολογικών διεργασιών.