Αντίδραση εξουδετέρωσης – Ορισμός και προϊόντα
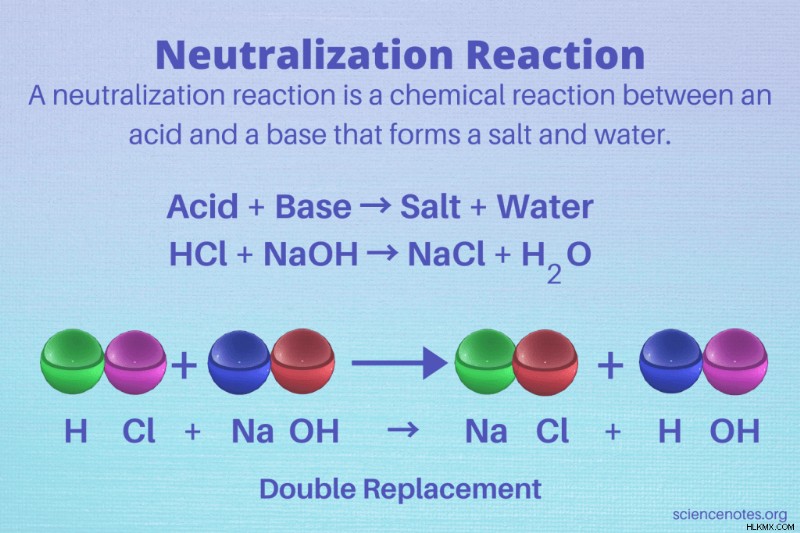
Μια αντίδραση εξουδετέρωσης είναι μια χημική αντίδραση μεταξύ ενός οξέος και μιας βάσης που σχηματίζει ένα άλας και νερό ως προϊόντα. Με άλλα λόγια, η αντίδραση εξουδετερώνει το οξύ και τη βάση. Μια αντίδραση εξουδετέρωσης είναι ένας τύπος αντίδρασης διπλής αντικατάστασης στην οποία τα αντιδρώντα είναι ένα οξύ και μια βάση.
Το οξύ απελευθερώνει ένα ιόν υδρογόνου στο νερό, ενώ η βάση απελευθερώνει ένα υδροξείδιο. Το υδρογόνο και το υδροξείδιο συνδυάζονται και σχηματίζουν νερό, ενώ το ανιόν από το οξύ και το κατιόν από τη βάση σχηματίζουν μια ιοντική ένωση που είναι άλας. Η εξουδετέρωση συμβαίνει μόνο εάν τόσο το οξύ όσο και η βάση είναι τουλάχιστον μερικώς διαλυτά στο νερό. Το άλας που είναι προϊόν της αντίδρασης μπορεί να είναι διαλυτό ή να σχηματίζει ίζημα.
Εάν ένα ισχυρό οξύ και μια ισχυρή βάση αντιδράσουν πλήρως, το αποτέλεσμα είναι ένα υδατικό διάλυμα με ουδέτερο pH (pH ~7,0). Ωστόσο, πολλές αντιδράσεις εξουδετέρωσης καταλήγουν σε διαλύματα με χαμηλότερες ή υψηλότερες τιμές pH.
Αντίδραση εξουδετέρωσης οξέος-βάσης
Γενικά, μια αντίδραση εξουδετέρωσης είναι ένας τύπος αντίδρασης διπλής αντικατάστασης μεταξύ ενός οξέος και μιας βάσης (αλκάλι). Η γενική μορφή της αντίδρασης είναι ένα οξύ και μια βάση που αντιδρούν και σχηματίζουν ένα άλας και νερό:
οξύ + βάση → αλάτι και νερό
Για παράδειγμα:
HCl + NaOH → NaCl + H2 O
Εναλλακτικά, μπορείτε να γράψετε την αντίδραση ως ιοντική εξίσωση:
H(aq) + Cl(aq) + Όχι( aq) + OH(aq) → Na(aq) + Cl(aq) + H2 O(l)
Ακυρώνοντας τα ιόντα θεατών, η καθαρή ιοντική εξίσωση είναι:
H(aq) + OH(aq) → H2 O(l)
Σημειώστε ότι το βέλος της αντίδρασης δείχνει προς τα δεξιά, υποδεικνύοντας ότι η αντίδραση προχωρά μόνο προς την κατεύθυνση προς τα εμπρός.
Η γενική μορφή της αντίδρασης που βασίζεται στη θεωρία οξέος-βάσης Brønsted–Lowry είναι:
AH + B → A + BH
Ισχυρό οξύ – Εξουδετέρωση ισχυρής βάσης
Ισχυρά οξέα και ισχυρές βάσεις διασπώνται πλήρως στο νερό και αντιδρούν, σχηματίζοντας ένα ουδέτερο άλας σε ένα ουδέτερο υδατικό διάλυμα. Η τελική τιμή pH είναι περίπου 7, αν και μπορεί να είναι ελαφρώς υψηλότερη ή χαμηλότερη, ανάλογα με τη θερμοκρασία.
Εδώ είναι τα πιο κοινά ισχυρά οξέα και βάσεις. Όταν αντιδρούν μεταξύ τους, αναμένετε μια τελική τιμή pH 7. Η αντίδραση των περισσότερων άλλων οξέων και βάσεων δίνει pH διαφορετικό από 7.
| Ισχυρά οξέα | Ισχυρές βάσεις |
|---|---|
| HCl | LiOH |
| HBr | NaOH |
| Γεια | KOH |
| HCIO4 | RbOH |
| HNO3 | CsOH |
| Ca(OH)2 | |
| Sr(OH)2 | |
| Ba(OH)2 |
Θειικό οξύ (H2 SO4 ) συμπεριφέρεται διαφορετικά από άλλα ισχυρά οξέα επειδή έχει δύο άτομα υδρογόνου. Ενώ το θειικό οξύ διασπάται πλήρως, το κάνει με σταδιακό τρόπο.
Ασθενές οξύ – Εξουδετέρωση ασθενούς βάσης
Τα αδύναμα οξέα και οι ασθενείς βάσεις δεν διασπώνται πλήρως στο νερό. Αντίθετα, σχηματίζεται ένα μείγμα ισορροπίας που περιέχει το ασθενές οξύ και τη συζυγή του βάση ή/και την ασθενή βάση και το συζυγές οξύ του.
AH + B ⇌ A + BH
Τα δύο είδη δεν εξουδετερώνουν πλήρως το ένα το άλλο. Η τιμή του pH μιας αντίδρασης εξουδετέρωσης μεταξύ ασθενούς οξέος και ασθενούς βάσης εξαρτάται από την ισχύ του ασθενούς οξέος και της βάσης. Το pH είναι 7 μόνο αν Ka =Kb. Εάν η ασθενής βάση είναι ισχυρότερη (Kb> Ka), το τελικό διάλυμα είναι αλκαλικό (pH> 7). Όσο ισχυρότερο είναι το ασθενές οξύ (Ka> Kb), το τελικό διάλυμα είναι όξινο (pH <7).
Ασθενή οξέα και ισχυρές βάσεις
Το τελικό pH μιας αντίδρασης εξουδετέρωσης μεταξύ ενός ασθενούς οξέος και μιας ισχυρής βάσης εξαρτάται από την ισχύ του ασθενούς οξέος.
AH + H2 O ⇌ H3 O + A
Ισχυρά οξέα και ασθενείς βάσεις
Το τελικό pH μιας αντίδρασης εξουδετέρωσης μεταξύ ενός ισχυρού οξέος και μιας ασθενούς βάσης εξαρτάται από τη σταθερά διάστασης οξέος της βάσης, pKa.
H3 O + B ⇌ H2 O + BH
Πρόβλεψη τιμών pH
Το pH μιας αντίδρασης εξουδετέρωσης εξαρτάται από τα χαρακτηριστικά των αντιδρώντων:
| Δύναμη οξέος και βάσης | pH |
|---|---|
| Ισχυρό οξύ – Ισχυρή βάση | 7 |
| Ισχυρό οξύ – ασθενής βάση | <7 |
| Ασθενές οξύ – Ισχυρή βάση | >7 |
| Ασθενές οξύ – Ασθενής βάση | pH <7 εάν Ka>Kb pH =7 αν Ka=Kb pH>7 εάν Ka |
Ο λόγος που το pH είναι χαμηλό αντιδρώντας ένα ισχυρό οξύ με μια αδύναμη βάση και ένα ασθενές οξύ υψηλής αντίδρασης με μια ισχυρή βάση είναι όχι λόγω του ισχυρού οξέος ή της ισχυρής βάσης. Αντίθετα, είναι επειδή το προκύπτον αλάτι επηρεάζει το pH. Η συζευγμένη βάση ενός ασθενούς οξέος καθιστά το διάλυμα αλκαλικό. Το συζυγές οξύ μιας ασθενούς βάσης κάνει το διάλυμα όξινο.
Πώς να προβλέψετε τα προϊόντα εξουδετέρωσης
Δύο συνήθεις ερωτήσεις που τίθενται στους μαθητές σχετικά με τις αντιδράσεις εξουδετέρωσης είναι η πρόβλεψη των προϊόντων της αντίδρασης και εάν το τελικό pH είναι όξινο, αλκαλικό ή ουδέτερο.
- Προσδιορίστε τα αντιδρώντα. Είναι η αντίδραση μεταξύ ισχυρού οξέος και ισχυρής βάσης ή υπάρχει ασθενές οξύ ή ασθενής βάση; Μια αντίδραση ισχυρής βάσης με ισχυρό οξύ σχηματίζει άλας και νερό και το pH είναι 7. Εάν υπάρχει ασθενές οξύ ή ασθενής βάση, το pH εξαρτάται από το αν το οξύ ή η βάση είναι ισχυρότερο.
- Διαχωρίστε το οξύ και τη βάση στα ιόντα τους. Το άλας είναι το κατιόν από τη βάση με το ανιόν από το οξύ. Το άλλο προϊόν είναι το νερό.
Για παράδειγμα, προσδιορίστε τα προϊόντα της αντίδρασης μεταξύ υδροχλωρικού οξέος (HCl) και υδροξειδίου του αργιλίου [Al(OH)3 ] και εάν το τελικό pH είναι όξινο, ουδέτερο ή αλκαλικό.
Γνωρίζετε είτε από γράφημα είτε από απομνημόνευση ότι το υδροχλωρικό οξύ είναι ισχυρό οξύ και το υδροξείδιο του αργιλίου δεν είναι ισχυρή βάση (άρα πρέπει να είναι αδύναμη βάση). Το pH της αντίδρασης μεταξύ ενός ισχυρού οξέος και μιας ασθενούς βάσης είναι μικρότερο από 7, επομένως το pH είναι όξινο.
Το υδροχλωρικό οξύ διασπάται σε Η και Cl, ενώ το υδροξείδιο του αργιλίου σε Al και 3 ΟΗ. Το άλας συνδυάζει το κατιόν από τη βάση (Al) με το ανιόν από το οξύ (Cl), σχηματίζοντας AlCl3 .
Ισορροπήστε την εξίσωση υποθέτοντας ότι ο αριθμός των γραμμομορίων οξέος (Η) ισούται με τον αριθμό των γραμμομορίων βάσης (ΟΗ):
3HCl + Al(OH)3 → AlCl3 + H2 O
Παραδείγματα αντιδράσεων εξουδετέρωσης στην καθημερινή ζωή
Οι αντιδράσεις εξουδετέρωσης είναι συχνές στην καθημερινή ζωή.
- Οι πίνακες αντιόξινων περιέχουν μια αδύναμη βάση (όπως διττανθρακικό νάτριο) που εξουδετερώνει την περίσσεια γαστρικού οξέος (HCl) στο στομάχι.
- Το ανθρώπινο πεπτικό σύστημα εξουδετερώνει επίσης το οξύ του στομάχου. Το πάγκρεας παράγει ένα διττανθρακικό αντιόξινο που επιτρέπει την απορρόφηση θρεπτικών συστατικών στα έντερα.
- Οι αδύναμες βάσεις, όπως το διττανθρακικό νάτριο, εξουδετερώνουν με ασφάλεια τις διαρροές οξέος και τα εγκαύματα.
- Η οδοντόκρεμα περιέχει μια αδύναμη βάση που εξουδετερώνει τα οξέα που απελευθερώνονται από τα βακτήρια στο στόμα.
- Το υδροξείδιο του ασβεστίου ή ο ασβεστόλιθος (ανθρακικό ασβέστιο) είναι επεξεργασίες εδάφους που αυξάνουν το pH και βοηθούν την ανάπτυξη των φυτών.
- Η παραγωγή λιπασμάτων περιλαμβάνει την εξουδετέρωση είτε του νιτρικού είτε του θειικού οξέος με αμμωνία, σχηματίζοντας νιτρικό αμμώνιο ή θειικό αμμώνιο.
- Οι καθαριστές εξουδετερώνουν τα οξέα που σχηματίζονται από την καύση άνθρακα.
- Μια τιτλοδότηση είναι μια αντίδραση εξουδετέρωσης που προσδιορίζει τη συγκέντρωση ενός άγνωστου διαλύματος.
Αναφορές
- Trummal, Aleksander; Lipping, Lauri; Kaljurand, Ivari; Koppel, Ilmar A.; Leito, Ivo (2016). «Οξύτητα ισχυρών οξέων στο νερό και διμεθυλοσουλφοξείδιο». The Journal of Physical Chemistry A . 120 (20):3663–3669. doi:10.1021/acs.jpca.6b02253
- Skoog, D.A; West, D.M.; Holler, J.F.; Crouch, S.R. (2004). Βασικές αρχές της αναλυτικής χημείας (8η έκδ.). Τόμσον Μπρουκς/Κόουλ. ISBN 0-03-035523-0.
- Snoeyink, V.L.; Jenkins, D. (1980). Υδατική χημεία:Χημικές ισορροπίες και ποσοστά σε φυσικά νερά . Νέα Υόρκη:Wiley. ISBN 0-471-51185-4.
- Zumdahl, Steven S. (2009). Χημικές Αρχές (6η έκδ.). Νέα Υόρκη:Houghton Mifflin Company.




