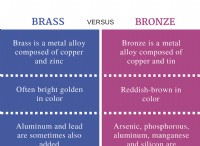
Ποια είναι τα μόρια έχει ένα λυγισμένο σχήμα;
λυγισμένη μοριακή γεωμετρία
Ένα μόριο έχει ένα λυγισμένο ή γωνιακό σχήμα όταν το κεντρικό άτομο έχει δύο ζεύγη συγκόλλησης και ένα ή δύο μοναχικά ζεύγη ηλεκτρονίων. Αυτό περιγράφεται συχνά χρησιμοποιώντας τη θεωρία VSEPR (Απομάκρυνση ζεύγους ηλεκτρονίων κελύφους σθένους).
γιατί τα λυγισμένα σχήματα εμφανίζονται
* Απομάκρυνση ζεύγους: Τα μοναχικά ζεύγη ηλεκτρονίων ασκούν ισχυρότερες απωθητικές δυνάμεις από τα ζεύγη συγκόλλησης. Αυτό ωθεί τα ζεύγη συγκόλλησης πιο κοντά, με αποτέλεσμα ένα λυγισμένο σχήμα.
* υβριδοποίηση: Το κεντρικό άτομο συχνά υφίσταται υβριδοποίηση, η οποία περιλαμβάνει την ανάμειξη ατομικών τροχιακών για να σχηματίσουν νέα υβριδικά τροχιακά που εμπλέκονται στη συγκόλληση. Αυτός ο υβριδισμός επηρεάζει επίσης το σχήμα.
Κοινά παραδείγματα μορίων με λυγισμένα σχήματα
1. νερό (h₂o)
* Κεντρικό άτομο:οξυγόνο (O)
* Ζεύγη συγκόλλησης:2 (σε άτομα υδρογόνου)
* Lone Pairs:2
* Λυγισμένο σχήμα λόγω της απόρριψης των μοναχικών ζευγών σε οξυγόνο.
2. υδρόθειο (h₂s)
* Κεντρικό άτομο:θείο (ες)
* Ζεύγη συγκόλλησης:2 (σε άτομα υδρογόνου)
* Lone Pairs:2
* Λυγισμένο σχήμα λόγω της απάντησης του ζεύγους, παρόμοια με το νερό.
3. Διοξείδιο του θείου (SO₂)
* Κεντρικό άτομο:θείο (ες)
* Ζεύγη συγκόλλησης:2 (σε άτομα οξυγόνου)
* Lone Pairs:1
* Λυγισμένο σχήμα λόγω της επίδρασης του μοναχικού ζεύγους στο θείο.
4. όζον (o₃)
* Κεντρικό άτομο:οξυγόνο (O)
* Ζεύγη συγκόλλησης:2 (σε άτομα οξυγόνου)
* Lone Pairs:1
* Λυγισμένο σχήμα λόγω της απόρριψης από το ζεύγος μοναχικού στο κεντρικό οξυγόνο.
Σημαντικές σημειώσεις
* υβριδοποίηση: Τα μόρια με λυγισμένα σχήματα συχνά περιλαμβάνουν τον υβριδισμό SP³ (για παράδειγμα, στο νερό).
* Γωνίες δεσμών: Η ακριβής γωνία του δεσμού σε ένα λυγισμένο μόριο εξαρτάται από το συγκεκριμένο μόριο και την αντοχή της απάντησης του ζεύγους μοναχικού ζεύγους.
Επιτρέψτε μου να ξέρω αν θέλετε μια πιο λεπτομερή εξήγηση για οποιοδήποτε συγκεκριμένο μόριο!