Πώς ξέρετε ποια στοιχεία θα σχηματίσουν ιοντικές ενώσεις μαζί;
Κατανόηση ιοντικών δεσμών
Οι ιοντικοί δεσμοί σχηματίζονται όταν ένα μέταλλο (τυπικά ένα κατιόν, θετικά φορτισμένο) μεταφέρει ηλεκτρόνια σε μη μέταλλο (συνήθως ένα ανιόν, αρνητικά φορτισμένο). Αυτή η μεταφορά δημιουργεί ηλεκτροστατική έλξη μεταξύ των αντίθετα φορτισμένων ιόντων, με αποτέλεσμα μια ένωση.
Παράγοντες που πρέπει να ληφθούν υπόψη:
1. Διαφορά ηλεκτροαρνητικότητας:
- Οι ιοντικοί δεσμοί γενικά σχηματίζονται όταν η διαφορά ηλεκτροαρνητικότητας μεταξύ δύο στοιχείων είναι μεγάλη.
- Η ηλεκτροαρνητικότητα είναι ένα μέτρο της ικανότητας ενός ατόμου να προσελκύει ηλεκτρόνια.
- Μια διαφορά 1,7 ή μεγαλύτερη στην κλίμακα ηλεκτροαρνητικότητας Pauling είναι συνήθως ενδεικτική ενός ιοντικού δεσμού.
2.
- Τα μέταλλα τείνουν να χάνουν ηλεκτρόνια και να σχηματίζουν κατιόντα.
- Τα μη μέταλλα τείνουν να κερδίζουν ηλεκτρόνια και να σχηματίζουν ανιόντα.
- Οι συνδυασμοί μετάλλων και μη μεταλλικών είναι πιο πιθανό να σχηματίσουν ιοντικές ενώσεις.
3. Τάσεις ομάδας:
- Ομάδα 1 (αλκαλικά μέταλλα): Αυτά τα στοιχεία χάνουν εύκολα ένα ηλεκτρόνιο για να σχηματίσουν +1 ιόντα (π.χ. Na+, K+).
- Ομάδα 2 (αλκαλικά μέταλλα γης): Αυτά τα στοιχεία χάνουν εύκολα δύο ηλεκτρόνια για να σχηματίσουν +2 ιόντα (π.χ. Mg2+, Ca2+).
- Ομάδα 17 (αλογόνα): Αυτά τα στοιχεία κερδίζουν εύκολα ένα ηλεκτρόνιο για να σχηματίσουν -1 ιόντα (π.χ. cl-, br-).
- Ομάδα 16 (Chalcogens): Αυτά τα στοιχεία μπορούν να κερδίσουν δύο ηλεκτρόνια για να σχηματίσουν -2 ιόντα (π.χ., O2-, S2-).
Παραδείγματα:
* Χλωριούχο νάτριο (NaCl): Το νάτριο (Na) είναι ένα μέταλλο, το χλώριο (CL) είναι μη μέταλλο. Το νάτριο έχει χαμηλότερη ηλεκτροαρνητικότητα και τείνει να χάσει ένα ηλεκτρόνιο για να σχηματίσει Na+. Το χλώριο έχει υψηλότερη ηλεκτροαρνητικότητα και κερδίζει ένα ηλεκτρόνιο για να σχηματίσει cl-. Η προκύπτουσα ηλεκτροστατική έλξη σχηματίζει έναν ιοντικό δεσμό.
* οξείδιο μαγνησίου (MGO): Το μαγνήσιο (mg) είναι ένα μέταλλο, το οξυγόνο (Ο) είναι μη μέταλλο. Το μαγνήσιο χάνει δύο ηλεκτρόνια για να σχηματίσει Mg2+, ενώ το οξυγόνο κερδίζει δύο ηλεκτρόνια για να σχηματίσει O2-. Αυτό οδηγεί σε ιοντικό δεσμό.
* βρωμιούχο κάλιο (KBR): Το κάλιο (k) είναι ένα μέταλλο, το βρωμίρο (BR) είναι μη μέταλλο. Το κάλιο χάνει ένα ηλεκτρόνιο για να σχηματίσει Κ+, ενώ το βρωμίρο κερδίζει ένα ηλεκτρόνιο για να σχηματίσει Br-. Και πάλι, μορφές ιοντικού δεσμού.
Σημαντικές σημειώσεις:
* Υπάρχουν εξαιρέσεις από τους γενικούς κανόνες. Ορισμένες ενώσεις με μικρότερη διαφορά ηλεκτροαρνητικότητας μπορεί να έχουν κάποιο ιοντικό χαρακτήρα, αλλά θεωρούνται πιο ομοιοπολικές.
* Τα πολυατομικά ιόντα, όπως τα νιτρικά (ΝΟ3-) ή το αμμώνιο (NH4+), μπορούν επίσης να συμμετάσχουν σε ιοντικά ομόλογα.
Εργαλεία για βοήθεια:
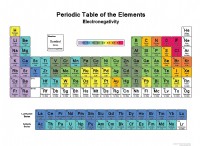
* Διαγράμματα ηλεκτροαρνητικότητας: Αυτά τα διαγράμματα παρέχουν τιμές ηλεκτροαρνητικότητας για στοιχεία.
* Περιοδικός πίνακας: Ο περιοδικός πίνακας σάς βοηθά να εντοπίσετε μέταλλα και μη μέταλλα.
Εάν χρειάζεστε βοήθεια για να καθορίσετε εάν συγκεκριμένα στοιχεία θα σχηματίσουν μια ιοντική ένωση, μπορείτε να παρέχετε τα στοιχεία και μπορώ να σας βοηθήσω να τα αναλύσετε!