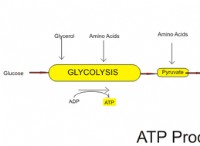
Ποια εξίσωση χρησιμοποιείται για τον υπολογισμό της ελεύθερης αλλαγής ενέργειας μιας αντίδρασης;
ΔG =ΔH - TΔS
Οπου:
* ΔG είναι η αλλαγή στην ελεύθερη ενέργεια του Gibbs (σε joules ή kilojoules)
* ΔH είναι η αλλαγή στην ενθαλπία (σε joules ή kilojoules)
* t είναι η θερμοκρασία (στο Kelvin)
* ΔS είναι η αλλαγή στην εντροπία (σε joules ανά Kelvin ή Kilojoules ανά Kelvin)
Επεξήγηση:
* Gibbs Free Energy (ΔG) είναι ένα θερμοδυναμικό δυναμικό που μπορεί να χρησιμοποιηθεί για την πρόβλεψη του αυθορμητισμού μιας διαδικασίας. Ένα αρνητικό Δg υποδεικνύει μια αυθόρμητη αντίδραση, ενώ ένα θετικό ΔG υποδηλώνει μια μη-νυχτερινή αντίδραση.
* Ενθαλπία (ΔH) Αντιπροσωπεύει τη μεταβολή της θερμικής περιεκτικότητας σε ένα σύστημα κατά τη διάρκεια μιας αντίδρασης. Ένα αρνητικό ΔH υποδεικνύει μια εξωθερμική αντίδραση (η θερμότητα απελευθερώνεται), ενώ ένα θετικό ΔH δείχνει μια ενδοθερμική αντίδραση (η θερμότητα απορροφάται).
* εντροπία (ΔS) Αντιπροσωπεύει τη μεταβολή της διαταραχής ή της τυχαιότητας ενός συστήματος κατά τη διάρκεια μιας αντίδρασης. Η αύξηση της εντροπίας (θετική ΔS) υποδεικνύει αύξηση της διαταραχής, ενώ η μείωση της εντροπίας (αρνητικό ΔS) υποδεικνύει μείωση της διαταραχής.
Βασικά σημεία:
* Η εξίσωση ισχύει σε σταθερή θερμοκρασία και πίεση.
* Οι μονάδες ΔG, ΔH και Δs πρέπει να είναι συνεπείς.
* Η ελεύθερη αλλαγή ενέργειας μπορεί να χρησιμοποιηθεί για την πρόβλεψη της σταθεράς ισορροπίας (k) μιας αντίδρασης.
Παράδειγμα:
Ας πούμε ότι έχετε μια αντίδραση με:
* ΔH =-100 kJ/mol
* ΔS =100 J/mol · K
* T =298 K
Στη συνέχεια, η αλλαγή στην ελεύθερη ενέργεια Gibbs θα ήταν:
ΔG =-100 kJ/mol -(298 K) (0,1 kJ/mol · k) =-129,8 kJ/mol
Δεδομένου ότι το ΔG είναι αρνητικό, η αντίδραση είναι αυθόρμητη στα 298 Κ.