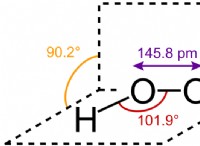
Πώς συγκρίνεται ένας ομοιοπολικός δεσμός με έναν ιοντικό δεσμό;
ομοιοπολικοί δεσμοί:
* σχηματισμός: Τα άτομα μοιράζονται ηλεκτρόνια για να επιτύχουν μια σταθερή διαμόρφωση ηλεκτρονίων.
* Ηλεκτροργατιστικότητα: Τα εμπλεκόμενα άτομα έχουν παρόμοιες ηλεκτροθετικές ικανότητες.
* Αντοχή δεσμού: Γενικά ισχυρότεροι από τους ιοντικούς δεσμούς.
* Φυσικές ιδιότητες: Συχνά σχηματίζουν αέρια, υγρά ή στερεά με χαμηλά σημεία τήξης και βρασμού.
* Διαλυτότητα: Συνήθως διαλυτά σε μη πολικούς διαλύτες (π.χ. νερό).
* αγωγιμότητα: Κακοί αγωγοί ηλεκτρικής ενέργειας.
* Παράδειγμα: Ο δεσμός μεταξύ δύο ατόμων υδρογόνου σε ένα μόριο υδρογόνου (Η).
Ιονικά ομόλογα:
* σχηματισμός: Ένα άτομο δωρίζει ηλεκτρόνια σε άλλο άτομο, δημιουργώντας ιόντα με αντίθετες χρεώσεις που προσελκύουν ο ένας τον άλλον.
* Ηλεκτροργατιστικότητα: Τα εμπλεκόμενα άτομα έχουν σημαντικά διαφορετικές ηλεκτροθεραπευτικές περιοχές.
* Αντοχή δεσμού: Γενικά ασθενέστερους από τους ομοιοπολικούς δεσμούς.
* Φυσικές ιδιότητες: Συχνά σχηματίζουν στερεά με υψηλά σημεία τήξης και βρασμού.
* Διαλυτότητα: Συνήθως διαλυτά σε πολικούς διαλύτες (π.χ. νερό).
* αγωγιμότητα: Καλοί αγωγοί ηλεκτρικής ενέργειας στην τετηγμένη ή διαλυμένη κατάσταση.
* Παράδειγμα: Ο δεσμός μεταξύ νατρίου (ΝΑ) και χλωρίου (CL) σε χλωριούχο νάτριο (NaCl).
Βασικές διαφορές με λίγα λόγια:
* Κοινή χρήση ηλεκτρονίων έναντι μεταφοράς ηλεκτρονίων: Οι ομοιοπολικοί δεσμοί περιλαμβάνουν την ανταλλαγή ηλεκτρονίων, ενώ οι ιοντικοί δεσμοί περιλαμβάνουν τη μεταφορά ηλεκτρονίων.
* Διαφορά ηλεκτροαρνητικότητας: Οι ομοιοπολικοί δεσμοί εμφανίζονται μεταξύ ατόμων με παρόμοιες ηλεκτροναυτικές ιδιότητες, ενώ οι ιοντικοί δεσμοί εμφανίζονται μεταξύ των ατόμων με σημαντικά διαφορετικές ηλεκτροθετικές ικανότητες.
* Αντοχή δεσμού: Οι ομοιοπολικοί δεσμοί είναι γενικά ισχυρότεροι από τους ιοντικούς δεσμούς.
* Φυσικές ιδιότητες: Οι ομοιοπολικές ενώσεις τείνουν να είναι πιο πτητικές και έχουν χαμηλότερα σημεία τήξης, ενώ οι ιοντικές ενώσεις είναι συνήθως στερεές και έχουν υψηλότερα σημεία τήξης.
* αγωγιμότητα: Οι ομοιοπολικές ενώσεις είναι κακοί αγωγοί ηλεκτρικής ενέργειας, ενώ οι ιοντικές ενώσεις είναι καλοί αγωγοί όταν λιωθούν ή διαλύονται.
Πίνακας συνοπτικών:
| Χαρακτηριστικό | Ομοιοπολικός δεσμός | Ιωνικός δεσμός |
--------------------------------------------------------------------------------------------
| Κοινή χρήση ηλεκτρονίων | Ναι | Όχι |
| Ηλεκτροαρολότητα | Παρόμοια | Διαφορετικά |
| Δύναμη δεσμού | Ισχυρότερη | Ασθενέστερος |
| Σημείο τήξης/βρασμού | Κατώτερο | Υψηλότερη |
| Αγωγιμότητα | Κακή | Καλό |
| Διαλυτότητα | Μη πολικός | Πολικός |
Είναι σημαντικό να σημειωθεί ότι πρόκειται για γενικεύσεις και ορισμένες ενώσεις μπορούν να παρουσιάσουν χαρακτηριστικά τόσο της ομοιοπολικής όσο και της ιοντικής σύνδεσης.