Διαφορά μεταξύ του κανόνα Markovnikov και του Anti Markovnikov
Κύρια διαφορά – Κανόνας Markovnikov εναντίον Anti Markovnikov
Χρησιμοποιούμε χημικές αντιδράσεις για να συνθέσουμε χημικές ενώσεις. Εάν διαθέτουμε τις απαιτούμενες ποσότητες αντιδρώντων και καταλυτών, μπορούμε να πάρουμε το επιθυμητό προϊόν παρέχοντας άλλες συνθήκες όπως η κατάλληλη θερμοκρασία. Αλλά μερικές φορές, η χημική αντίδραση μπορεί να μην δώσει την επιθυμητή ένωση ή μπορεί να δώσει ένα μείγμα προϊόντων που αποτελείται από το επιθυμητό προϊόν καθώς και άλλα προϊόντα. Αυτή η κατάσταση μπορεί να εξηγηθεί χρησιμοποιώντας τον κανόνα Markovnikov. Ο κανόνας Markovnikov εξηγεί γιατί ένα συγκεκριμένο άτομο ή μια ομάδα συνδέεται με ένα συγκεκριμένο άτομο άνθρακα αντί για οποιοδήποτε άλλο άτομο άνθρακα στο ίδιο μόριο. Ο κανόνας Anti Markovnikov εξηγεί την αντίθετη κατάσταση από τον κανόνα Markovnikov. Η κύρια διαφορά μεταξύ του κανόνα Markovnikov και του κανόνα Anti Markovnikov είναι ότι Ο κανόνας Markovnikov υποδεικνύει ότι τα άτομα υδρογόνου σε μια αντίδραση προσθήκης συνδέονται με το άτομο άνθρακα με περισσότερους υποκαταστάτες υδρογόνου ενώ ο κανόνας Anti Markovnikov υποδεικνύει ότι τα άτομα υδρογόνου συνδέονται με το άτομο άνθρακα με τους λιγότερους υποκαταστάτες υδρογόνου .
Βασικές περιοχές που καλύπτονται
1. Τι είναι ο κανόνας Markovnikov
– Ορισμός, Μηχανισμός Αντίδρασης
2. Τι είναι ο κανόνας Anti Markovnikov
– Ορισμός, Μηχανισμός Αντίδρασης
3. Ποια είναι η διαφορά μεταξύ του κανόνα Markovnikov και του κανόνα Anti Markovnikov
– Σύγκριση βασικών διαφορών
Βασικοί όροι:Κανόνας Anti Markovnikov, Καταλύτες, Κανόνας Markovnikov, Αντιδρώντα, Τοποεπιλεκτικότητα
Τι είναι ο κανόνας Markovnikov
Ο κανόνας Markovnikov εξηγεί ότι στις πρόσθετες αντιδράσεις αλκενίων ή αλκυνίων, το πρωτόνιο προστίθεται στο άτομο άνθρακα που έχει τον μεγαλύτερο αριθμό ατόμων υδρογόνου συνδεδεμένα σε αυτό. Αυτός ο κανόνας είναι πολύ χρήσιμος για την πρόβλεψη του τελικού προϊόντος μιας συγκεκριμένης χημικής αντίδρασης. Ας κατανοήσουμε αυτόν τον κανόνα με τη βοήθεια ενός παραδείγματος.
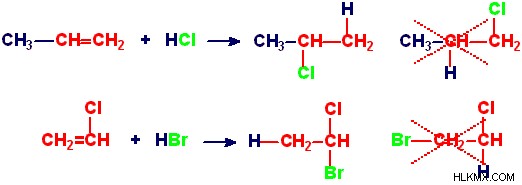
Εικόνα 1:Εφαρμογή του κανόνα Markovnikov για μια χημική αντίδραση
Όπως φαίνεται στο παραπάνω παράδειγμα, το πρωτόνιο ή το άτομο υδρογόνου είναι συνδεδεμένο με το άτομο άνθρακα που έχει ήδη τον μεγαλύτερο αριθμό ατόμων υδρογόνου συνδεδεμένα σε αυτό. Το αντίθετο ιόν συνδέεται με το άλλο άτομο άνθρακα. Το τελικό προϊόν είναι ένα αλκάνιο.
Αυτό συμβαίνει λόγω του σχηματισμού του πιο σταθερού καρβοκατιόντος ως ενδιάμεσου για την αντίδραση. Η προσθήκη του ατόμου υδρογόνου στο άτομο άνθρακα ανοίγει τον διπλό δεσμό. Αυτό δίνει στο άλλο άτομο άνθρακα βινυλίου ένα θετικό φορτίο. Αυτό το καρβοκατιόν θα πρέπει να είναι ένα σταθερό καρβοκατιόν προκειμένου να σχηματιστεί ένα σταθερό προϊόν στο τέλος. Μετά τον σχηματισμό του σωστού καρβοκατιόντος, το ιόν χλωρίου προσκολλάται στο θετικά φορτισμένο άτομο άνθρακα.
Ωστόσο, στο τέλος της αντίδρασης, παίρνουμε ένα μείγμα προϊόντων. αυτό το μείγμα αποτελείται από το προϊόν που δίνεται από το σταθερό καρβοκατιόν και το ασταθές καρβοκατιόν.
Τι είναι ο κανόνας Anti Markovnikov
Ο κανόνας Anti Markovnikov εξηγεί ότι στις πρόσθετες αντιδράσεις αλκενίων ή αλκυνίων, το πρωτόνιο προστίθεται στο άτομο άνθρακα που έχει τον μικρότερο αριθμό ατόμων υδρογόνου συνδεδεμένα σε αυτό. Το τελικό προϊόν που λαμβάνεται από αυτή την αντίδραση ονομάζεται προϊόν Anti Markovnikov. Αυτός ο μηχανισμός δεν περιλαμβάνει το σχηματισμό ενός ενδιάμεσου καρβοκατιόντος. Οι χημικές αντιδράσεις μπορούν να μετατραπούν σε αντιδράσεις που δίνουν το προϊόν Anti Markovnikov προσθέτοντας ένα υπεροξείδιο όπως το HOOH στο μείγμα της αντίδρασης.
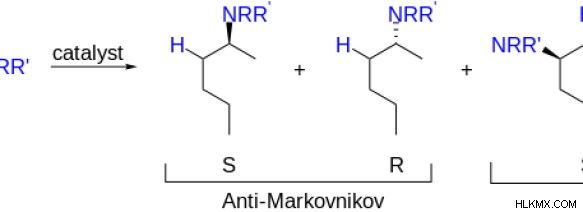
Εικόνα 2:Όλα τα πιθανά προϊόντα προσθήκης HNNR'
Εδώ λαμβάνει χώρα το φαινόμενο του υπεροξειδίου. Ένα υπεροξείδιο μπορεί να αλλάξει την τοποεπιλεκτικότητα μιας αντίδρασης προσθήκης. Τοποεπιλεκτικότητα είναι ο σχηματισμός ενός δεσμού σε ένα συγκεκριμένο άτομο πάνω από όλα τα άλλα πιθανά άτομα. Επομένως, το υπεροξείδιο δρα ως καταλύτης.
Διαφορά μεταξύ του κανόνα Markovnikov και Anti Markovnikov
Ορισμός
Κανόνας Markovnikov: Ο κανόνας Markovnikov εξηγεί ότι στις πρόσθετες αντιδράσεις αλκενίων ή αλκυνίων, το πρωτόνιο προστίθεται στο άτομο άνθρακα που έχει τον μεγαλύτερο αριθμό ατόμων υδρογόνου συνδεδεμένα σε αυτό.
Κανόνας Anti Markovnikov: Ο κανόνας Anti Markovnikov εξηγεί ότι στις πρόσθετες αντιδράσεις αλκενίων ή αλκυνίων, το πρωτόνιο προστίθεται στο άτομο άνθρακα που έχει τον μικρότερο αριθμό ατόμων υδρογόνου συνδεδεμένα σε αυτό.
Άτομο άνθρακα
Κανόνας Markovnikov: Σύμφωνα με τον κανόνα Markovnikov, το άτομο υδρογόνου συνδέεται με το άτομο άνθρακα με τον μεγαλύτερο αριθμό υποκαταστατών υδρογόνου.
Κανόνας Anti Markovnikov: Σύμφωνα με τον κανόνα Anti Markovnikov, το άτομο υδρογόνου συνδέεται με το άτομο άνθρακα με τον λιγότερο αριθμό υποκαταστατών υδρογόνου.
Προσθήκη
Κανόνας Markovnikov: Το αρνητικό μέρος της προσθήκης (δηλαδή X¯ ή Cl¯/Br¯) πηγαίνει στον άνθρακα που έχει λιγότερο αριθμό ατόμων υδρογόνου συνδεδεμένα σε αυτόν.
Κανόνας Anti Markovnikov: Το αρνητικό μέρος της προσθήκης πηγαίνει στον άνθρακα που έχει περισσότερο αριθμό ατόμων υδρογόνου συνδεδεμένα σε αυτόν.
Συμπέρασμα
Οι κανόνες Markovnikov και Anti Markovnikov είναι πολύ σημαντικοί για την πρόβλεψη των τελικών προϊόντων μιας χημικής αντίδρασης. Η κύρια διαφορά μεταξύ του κανόνα Markovnikov και του κανόνα Anti Markovnikov είναι ότι ο κανόνας Markovnikov υποδεικνύει ότι τα άτομα υδρογόνου σε μια αντίδραση προσθήκης συνδέονται με το άτομο άνθρακα με περισσότερα υποκατάστατα υδρογόνου, ενώ ο κανόνας Anti Markovnikov δείχνει ότι τα άτομα υδρογόνου συνδέονται με το άτομο άνθρακα με τα λιγότερα υποκατάστατα υδρογόνου. .




