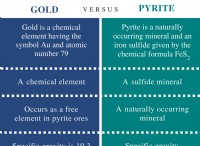
Πώς αντιδρά το υδρογόνο στη φωτιά;
Βασική αντίδραση:
* Το υδρογόνο είναι εξαιρετικά εύφλεκτο: Καίει εύκολα παρουσία οξυγόνου.
* Η αντίδραση παράγει νερό: 2H₂ + O₂ → 2H₂O (αυτή είναι η χημική εξίσωση)
* απελευθερώνει σημαντική ενέργεια: Αυτό έχει ως αποτέλεσμα μια πολύ καυτή φλόγα.
Ειδικές συνθήκες:
* καθαρό υδρογόνο: Καίει με μια σχεδόν αόρατη μπλε φλόγα.
* Μείγματα υδρογόνου: Το χρώμα της φλόγας μπορεί να ποικίλει ανάλογα με το μείγμα.
* Ποσοστό καύσης: Η ταχύτητα της αντίδρασης εξαρτάται από τη συγκέντρωση του υδρογόνου και του οξυγόνου, καθώς και από τη θερμοκρασία και την πίεση.
* Εκρηκτικό δυναμικό: Σε ορισμένες συγκεντρώσεις και πιέσεις, ένα μίγμα υδρογόνου-αέρα μπορεί να γίνει εξαιρετικά εκρηκτικό.
Ενδιαφέροντα γεγονότα:
* Η καταστροφή του Hindenburg: Ένα κλασικό παράδειγμα της εκρηκτικής φύσης του υδρογόνου, αυτό το περιστατικό οδήγησε στον ευρύτατο φόβο του υδρογόνου ως πηγή καυσίμου.
* υδρογόνο ως καύσιμο: Παρά τους κινδύνους, το υδρογόνο θεωρείται ως καθαρή και αποτελεσματική πηγή καυσίμου για το μέλλον.
Σκέψεις ασφάλειας:
* ακραία ευφλεκτότητα: Χειριστείτε το υδρογόνο με μεγάλη προσοχή.
* Εκρηκτικά μείγματα: Εξασφαλίστε τον κατάλληλο εξαερισμό και αποφύγετε τη δημιουργία μιγμάτων με αέρα.
* σωστή αποθήκευση και χειρισμός: Συμβουλευτείτε τις οδηγίες ασφαλείας για την αποθήκευση και τη διαχείριση του υδρογόνου.
Συνοπτικά, το υδρογόνο αντιδρά με πυρκαγιά καίγοντας ταχέως με οξυγόνο για να παράγει νερό και σημαντική ενέργεια. Αυτή η αντίδραση μπορεί να είναι εξαιρετικά αποτελεσματική και καθαρή, αλλά δημιουργεί επίσης σημαντικούς κινδύνους λόγω της ευφλεκτότητας και του εκρηκτικού δυναμικού του υδρογόνου.