Διαφορά μεταξύ ισχυρών και αδύναμων οξέων
Κύρια διαφορά – Ισχυρά έναντι αδύναμα οξέα
Ένα οξύ είναι ένα μόριο ή άλλο είδος που μπορεί να δώσει ένα πρωτόνιο ή να δεχθεί ένα ζεύγος ηλεκτρονίων σε αντιδράσεις. Τα οξέα ταξινομούνται σε δύο ομάδες γνωστές ως ισχυρά οξέα και αδύναμα οξέα. Η κύρια διαφορά μεταξύ ισχυρών και αδύναμων οξέων είναι ότι ισχυρά οξέα διασπώνται πλήρως σε υδατικά διαλύματα ενώ τα ασθενή οξέα διασπώνται μερικώς σε υδατικά διαλύματα.
Βασικές περιοχές που καλύπτονται
1. Τι είναι ένα ισχυρό οξύ
– Ορισμός, Ιδιότητες, Παραδείγματα
2. Τι είναι ένα αδύναμο οξύ
– Ορισμός, Ιδιότητες, Παραδείγματα
3. Ποια είναι η διαφορά μεταξύ Ισχυρού και Ασθενούς Οξέος
– Σύγκριση βασικών διαφορών
Βασικοί όροι:οξύ, σταθερά διάστασης οξέος, αποπρωτονίωση, pH, πολικότητα, πρωτόνιο, ισχυρό οξύ, ασθενές οξύ
Τι είναι ένα ισχυρό οξύ
Τα ισχυρά οξέα είναι μόρια που διασπώνται πλήρως στα ιόντα τους όταν βρίσκονται στο νερό. Με άλλα λόγια, τα οξέα απελευθερώνουν ιόντα Η στο διάλυμα με τον πλήρη ιονισμό τους. Η ισχύς ενός οξέος χαρακτηρίζεται από τη σταθερά διάστασης οξέος τιμές (Ka ). Κανονικά, τα ισχυρά οξέα έχουν πολύ μεγάλο Ka αξία.
Όσο ισχυρότερο είναι το οξύ, τόσο πιο εύκολα χάνει πρωτόνια. Αυτά τα πρωτόνια απελευθερώνονται εύκολα λόγω της υψηλής πολικότητας του δεσμού μεταξύ του ατόμου Η και του υπόλοιπου μορίου. Αυτή η πολικότητα καθορίζεται από την ηλεκτραρνητικότητα δύο ατόμων που εμπλέκονται σε αυτόν τον δεσμό. Η αποπρωτονίωση (αφαίρεση πρωτονίου) ενός ισχυρού οξέος εξαρτάται από την πολικότητα και το μέγεθος του ανιόντος στο οποίο είναι συνδεδεμένο το πρωτόνιο.
Για παράδειγμα, εάν ληφθεί υπόψη ένα οξύ που ονομάζεται Η-Α, η διάσταση του οξέος ΗΑ μπορεί να δοθεί ως,
HA(aq) + H2 O(l) à A(aq) + H3 O(aq)
Αλλά εάν το μόριο οξέος έχει περισσότερα από ένα πρωτόνια που μπορούν να απελευθερωθούν, μπορεί να εμφανιστεί όπως παρακάτω. Το παρακάτω παράδειγμα δείχνει τη διάσταση ενός διπρωτικού οξέος. Αυτό σημαίνει ότι μπορεί να απελευθερώσει δύο πρωτόνια.
H2 B(aq) + H2 O(l) à B(aq) + H3 O(aq)
Από την άλλη πλευρά, το pH του διαλύματος επηρεάζεται σε μεγάλο βαθμό από τα ισχυρά οξέα επειδή τα ισχυρά οξέα απελευθερώνουν ιόντα Η+ στο διάλυμα. Το pH εξαρτάται από τη συγκέντρωση Η+. Η σχέση μεταξύ της συγκέντρωσης Η+ και του pH μπορεί να δοθεί όπως παρακάτω.
pH = -log[H(aq) ]
Εάν το οξύ είναι ισχυρό οξύ, η τιμή του pH είναι πολύ μικρή τιμή. Για παράδειγμα, εάν ένα ισχυρό μονοπρωτικό οξύ βρίσκεται σε νερό σε συγκέντρωση 0,1 mol, το pH του διαλύματος θα είναι,
pH = -log[H(aq) ]
pH = -log[0.1 molL ]
= 1
Παραδείγματα ισχυρών οξέων
- Υδροχλωρικό οξύ (HCl)
- Νιτρικό οξύ (HNO3 )
- Θειικό οξύ (H2 SO4 )
- Υδροβρωμικό οξύ (HBr)
- Υδροϊωδικό οξύ (HI)
- Περχλωρικό οξύ (HClO4 )
- Χλωρικό οξύ (HClO3 )
Τι είναι ένα αδύναμο οξύ
Τα αδύναμα οξέα είναι μόρια που διασπώνται μερικώς σε ιόντα σε υδατικά διαλύματα. Τα ασθενή οξέα δεν απελευθερώνουν όλα τα ιόντα Η στο διάλυμα. Η σταθερά διάστασης οξέος (Ka ) είναι μικρή τιμή από αυτή των ισχυρών οξέων. Το pH του διαλύματος είναι περίπου 3-5. Αυτό συμβαίνει επειδή το ασθενές οξύ δεν αυξάνει τη συγκέντρωση Η+ ενός διαλύματος όπως κάνει ένα ισχυρό οξύ. Σε ένα σύστημα ασθενούς οξέος στο νερό, υπάρχουν ιόντα Η+, ανιόντα του μορίου και το μόριο ασθενούς οξέος που υπάρχουν στο διάλυμα.
Για παράδειγμα, η διάσταση του αιθανοϊκού οξέος μπορεί να παρουσιαστεί όπως παρακάτω.
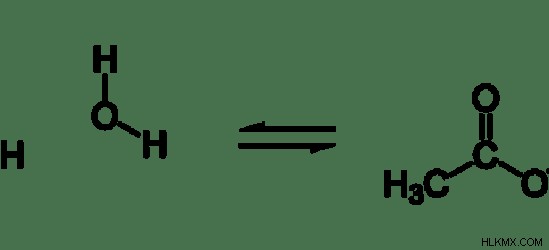
Εικόνα 1:Διάσπαση του αιθανικού οξέος
Όταν γράφετε τη διάσταση ασθενών οξέων, θα πρέπει να χρησιμοποιήσετε διπλά βέλη αντί για ένα μόνο βέλος. Αυτό σημαίνει ότι η αντίδραση είναι μια αντίδραση ισορροπίας.
Παραδείγματα αδύναμων οξέων
- Θειικό οξύ (H2 SO3 )
- Φωσφορικό οξύ (H3 PO4 )
- Υδροφθορικό οξύ (HF)
- Νιτρώδες οξύ (HNO2 )
- Βενζοϊκό οξύ (C6 H5 COOH)
- Μυρμηκικό οξύ (HCOOH)
- Οξικό οξύ (CH3 COOH)
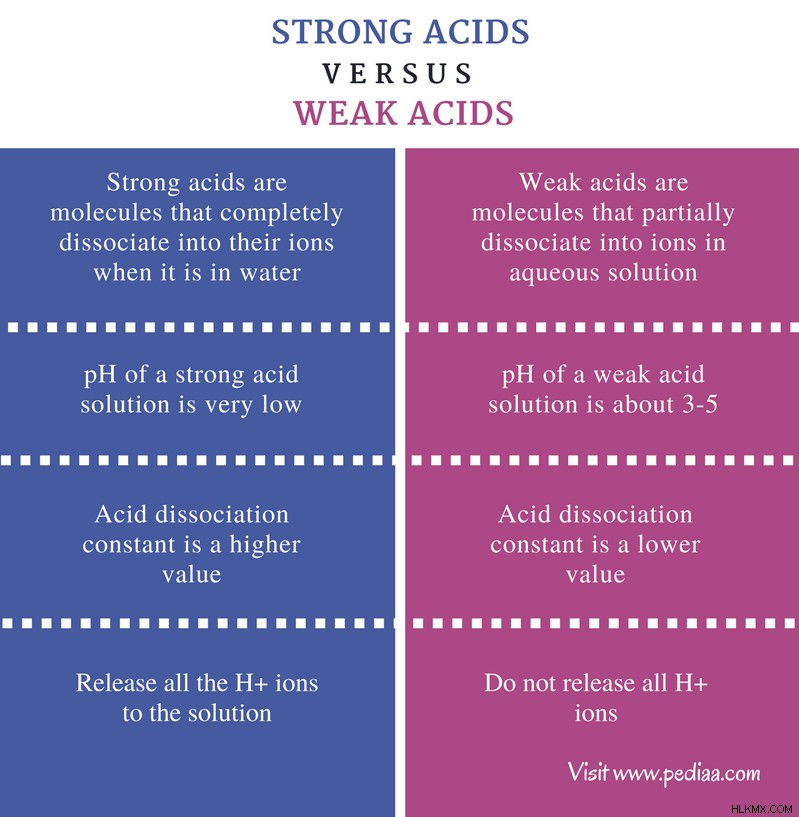
Διαφορά μεταξύ ισχυρών και αδύναμων οξέων
Ορισμός
Ισχυρό οξύ: Τα ισχυρά οξέα είναι μόρια που διασπώνται πλήρως στα ιόντα τους όταν βρίσκονται στο νερό.
Ασθενές οξύ: Τα αδύναμα οξέα είναι μόρια που διασπώνται μερικώς σε ιόντα σε υδατικό διάλυμα.
pH
Ισχυρό οξύ: Το pH ενός διαλύματος ισχυρού οξέος είναι πολύ χαμηλό (περίπου pH=1).
Ασθενές οξύ: Το pH ενός διαλύματος ασθενούς οξέος είναι περίπου 3-5.
Σταθερά διάστασης οξέος
Ισχυρό οξύ: Η σταθερά διάστασης οξέος Ka είναι υψηλότερη τιμή για τα ισχυρά οξέα.
Ασθενές οξύ: Η σταθερά διάστασης οξέος Ka είναι χαμηλότερη τιμή για ισχυρά οξέα.
Ποσότητα ιόντων H+ που απελευθερώθηκαν
Ισχυρό οξύ: Τα ισχυρά οξέα απελευθερώνουν όλα τα ιόντα Η που μπορεί να απελευθερώσει στο διάλυμα.
Ασθενές οξύ: Τα ασθενή οξέα δεν απελευθερώνουν όλα τα ιόντα Η.
Συμπέρασμα
Η ισχύς ενός οξέος καθορίζεται από την πολικότητα και τα ατομικά μεγέθη του μορίου του οξέος. Σύμφωνα με τον τρόπο με τον οποίο τα μόρια οξέος διασπώνται στο νερό, υπάρχουν δύο τύποι οξέων ως ισχυρά οξέα και αδύναμα οξέα. Η κύρια διαφορά μεταξύ ισχυρών και αδύναμων οξέων είναι ότι τα ισχυρά οξέα διασπώνται πλήρως σε υδατικά διαλύματα ενώ τα αδύναμα οξέα διαχωρίζονται μερικώς σε υδατικά διαλύματα.