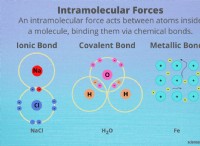
Ποια είναι η διαφορά διπολική και ομοιοπολική;
ομοιοπολικοί δεσμοί:
* Ορισμός: Οι ομοιοπολικοί δεσμοί σχηματίζονται όταν δύο άτομα μοιράζονται ηλεκτρόνια.
* Μηχανισμός: Τα άτομα μοιράζονται ηλεκτρόνια για να επιτύχουν μια πιο σταθερή διαμόρφωση ηλεκτρονίων, που μοιάζει με ένα ευγενές αέριο.
* Τύποι:
* μη πολική ομοιοπολική: Ίση κοινή χρήση ηλεκτρονίων. Αυτό συμβαίνει μεταξύ των ατόμων του ίδιου στοιχείου (π.χ., Η2, Ο2) ή των ατόμων με πολύ παρόμοια ηλεκτροαρνητικότητα (π.χ. CL2).
* Polar Covalent: Μη εξόριστη ανταλλαγή ηλεκτρονίων. Αυτό συμβαίνει μεταξύ ατόμων με διαφορετική ηλεκτροαρνητικότητα (π.χ., H2O, HCl). Το άτομο με υψηλότερη ηλεκτροαρνητικότητα τραβά τα ηλεκτρόνια πιο κοντά, δημιουργώντας ένα μερικό αρνητικό φορτίο (δ-) σε αυτό το άτομο και ένα μερικό θετικό φορτίο (δ+) από το άλλο άτομο.
Dipoles:
* Ορισμός: Ένα δίπολο είναι ένας διαχωρισμός του ηλεκτρικού φορτίου μέσα σε ένα μόριο.
* Μηχανισμός: Τα δίπολα προκύπτουν από την ανομοιογενή κατανομή της πυκνότητας ηλεκτρονίων μέσα σε ένα μόριο.
* Τύποι:
* Μόνιμα διπόλματα: Εμφανίζονται σε πολικούς ομοιοπολικούς δεσμούς , όπου η διαφορά στην ηλεκτροαρνητικότητα δημιουργεί έναν μόνιμο διαχωρισμό του φορτίου.
* Προσωρινά διπόλια (στιγμιαία διπόλια): Εμφανίζονται σε μη πολικούς ομοιοπολικούς δεσμούς , λόγω προσωρινών διακυμάνσεων στην πυκνότητα του νέφους ηλεκτρονίων, δημιουργώντας έναν προσωρινό διαχωρισμό του φορτίου.
Βασικές διαφορές:
* ομοιοπολικά ομόλογα Περιγράψτε Πώς τα άτομα συνδέονται Μέσα σε ένα μόριο με κοινή χρήση ηλεκτρονίων.
* Dipoles Περιγράψτε τη διανομή μέσα σε ένα μόριο, το οποίο μπορεί να προκύψει από τη φύση των ομοιοπολικών δεσμών.
Παράδειγμα:
* Στο νερό (H2O) , το άτομο οξυγόνου έχει υψηλότερη ηλεκτροαρνητικότητα από τα άτομα υδρογόνου. Αυτό δημιουργεί ένα πολικό ομοιοπολικό δεσμό , όπου το άτομο οξυγόνου φέρει ένα μερικό αρνητικό φορτίο και τα άτομα υδρογόνου φέρουν μερικές θετικές χρεώσεις. Αυτή η ανομοιόμορφη κατανομή του φορτίου έχει ως αποτέλεσμα ένα μόνιμο διπό Μέσα στο μόριο του νερού.
Συνοπτικά:
Οι ομοιοπολικοί δεσμοί είναι ο τρόπος που τα άτομα μοιράζονται ηλεκτρόνια για να σχηματίσουν μόρια. Τα δίπολα είναι αποτέλεσμα της ανομοιόμορφης κατανομής φορτίου μέσα σε ένα μόριο, που συχνά προκαλείται από την πολική φύση των ομοιοπολικών δεσμών.