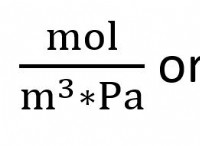Πώς υπολογίστε το μοριακό βάρος του οξικού οξέος;
1. Προσδιορίστε τα στοιχεία και τα ατομικά τους βάρη:
* άνθρακα (c): 12.011 g/mol
* υδρογόνο (h): 1.008 g/mol
* οξυγόνο (o): 15.999 g/mol
2. Μετρήστε τον αριθμό των ατόμων κάθε στοιχείου:
* άνθρακα (c): 2 άτομα
* υδρογόνο (h): 4 άτομα
* οξυγόνο (o): 2 άτομα
3. Πολλαπλασιάστε το ατομικό βάρος με τον αριθμό των ατόμων για κάθε στοιχείο:
* άνθρακα: 12.011 g/mol * 2 =24.022 g/mol
* υδρογόνο: 1.008 g/mol * 4 =4.032 g/mol
* οξυγόνο: 15.999 g/mol * 2 =31.998 g/mol
4. Προσθέστε τα αποτελέσματα μαζί:
24.022 g/mol + 4.032 g/mol + 31.998 g/mol = 60.052 g/mol
Επομένως, το μοριακό βάρος του οξικού οξέος (ch₃cooh) είναι 60.052 g/mol