Νόμος του Χένρι
Όταν ανοίγετε ένα κουτάκι αναψυκτικού, ακούτε ένα παράδειγμα του νόμου του Henry. Όταν ανοίγετε το δοχείο, η πίεση του διοξειδίου του άνθρακα μειώνεται γρήγορα. Σύμφωνα με το νόμο του Henry, η συγκέντρωση διοξειδίου του άνθρακα στο ποτό θα μειωθεί επίσης. Ο ήχος συριγμού που ακούτε είναι το διοξείδιο του άνθρακα που διαφεύγει από το υγρό. Μάθετε περισσότερα για το νόμο του Henry παρακάτω.
Τι είναι ο νόμος του Henry;
Ο νόμος του Henry περιγράφει τη σχέση μεταξύ της μερικής πίεσης του αερίου πάνω από ένα υγρό και του αερίου που διαλύεται στο υγρό. Γενικά, όσο μεγαλύτερη είναι η πίεση, τόσο περισσότερο αέριο θα διαλυθεί στο υγρό. Αυτή η σχέση περιγράφεται από την ακόλουθη εξίσωση:
Διαλυτότητα =Henry's Constant * Μερική πίεση αερίου
Cg =kPg
Cg =Συγκέντρωση διαλυμένου αερίου
K =Henry’s Constant
Pg =Μερική πίεση του αερίου
Η σταθερά στην εξίσωση εξαρτάται από το αέριο που εξετάζεται. Η εξίσωση συζητείται με περισσότερες λεπτομέρειες παρακάτω μαζί με παραδείγματα.
Ο νόμος μπορεί να χρησιμοποιηθεί ακόμη και όταν υπάρχουν πολλά αέρια. Η ατμοσφαιρική χημεία και η περιβαλλοντική έρευνα χρησιμοποιούν συνήθως τον νόμο του Henry καθώς εξετάζουν τα αέρια που περνούν πέρα δώθε μεταξύ της ατμόσφαιρας και των υδάτινων συστημάτων μας.
Η σταθερά του νόμου του Χένρι
Η σταθερά στο νόμο του Henry καθορίζεται μέσω πειραματισμού. Η πίεση του αερίου πάνω από το υγρό ελέγχεται προσεκτικά και στη συνέχεια μετράται η συγκέντρωση στο διάλυμα. Η σταθερά προσδιορίζεται πειραματικά διαιρώντας τη συγκέντρωση με τη μερική πίεση σε διαφορετικά σημεία.
Οι μονάδες στη σταθερά είναι συνήθως mol*m*Pa που είναι το ίδιο πράγμα με το mol *L*atm. Σε μορφή κλασμάτων, αυτές οι μονάδες θα εμφανίζονται ως εξής:
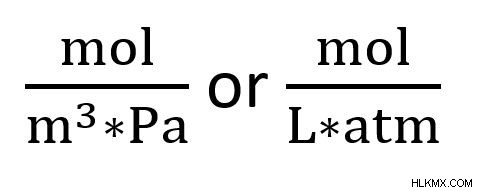
Λίστα των σταθερών του νόμου του Henry
Παρακάτω είναι μια λίστα με τις σταθερές του νόμου του Henry για ορισμένα κοινά αέρια στο νερό. Μια πιο πλήρης λίστα μπορεί να βρεθεί σε αυτό το άρθρο και είναι η πηγή για τις σταθερές που αναφέρονται παρακάτω. Υπάρχει επίσης μια βάση δεδομένων σταθερών με δυνατότητα αναζήτησης με βάση το παραπάνω χαρτί σε αυτόν τον σύνδεσμο.
| Αέριο στο νερό | Η σταθερά του νόμου του Henry (mol*m*Pa) | Η σταθερά του νόμου του Henry (mol*L*atm) |
| Υδροβρώμιο (HBr) | 0,24 | 24.3 |
| Περχλωρικό οξύ (HClO4 ) | 9,9 * 10 | 1,0 * 10 |
| Υδροφθόριο (HF) | 1,3 * 10 | 1,32 * 10 |
| Νιτρικό οξύ (HNO3 ) | 2.1 * 10 | 2.12 * 10 |
| Υδρογόνο (H2 ) | 7,7 * 10 | 7,8 * 10 |
| Δευτέριο (D2 ) | 7,9 * 10 | 8,0 * 10 |
| Οξυγόνο (O2 ) | 1,2 * 10 | 1,2 * 103 |
| Βρώμιο (Br2 ) | 7.2 * 10 | 0,73 |
| Διοξείδιο του θείου (SO2 ) | 1,2 * 10 | 1.22 |
| Μεθάνιο (CH4 ) | 1,4 * 10 | 1,41 * 10 |
| Βενζόλιο (C6 H6 ) | 1,8 * 10 | 0,18 |
Περιορισμοί του νόμου του Henry
Υπάρχουν πολλές περιπτώσεις όπου ο νόμος του Henry αποδεικνύεται ότι δεν είναι ακριβής.
Πρώτον, το σύστημα πρέπει να βρίσκεται σε ισορροπία. Εάν το σύστημα δεν βρίσκεται σε ισορροπία, τότε η συγκέντρωση στο διάλυμα βάσει του νόμου θα είναι ανακριβής. Για μια περιγραφή του τι είναι η ισορροπία, ανατρέξτε σε αυτό το άρθρο ChemTalk.
Η εξίσωση επίσης δεν λειτουργεί καλά εάν το αέριο αντιδράσει με τον διαλύτη. Η αντίδραση σημαίνει ότι ο νόμος του Henry δεν ισχύει για την κατάσταση.
Και ο τρίτος περιορισμός είναι ότι ο νόμος καταρρέει σε υψηλές συγκεντρώσεις και πιέσεις.
Παράδειγμα προβλημάτων
Ερώτηση #1: Ποια είναι η συγκέντρωση του υδρογόνου στο νερό όταν η μερική πίεση του υδρογόνου είναι 3 atm;
Απάντηση και λύση #1: Για να απαντήσουμε σε αυτό το πρόβλημα θα χρησιμοποιήσουμε την εξίσωση από το νόμο. Από τον παραπάνω πίνακα, γνωρίζουμε ότι η σταθερά του Henry για το υδρογόνο στο νερό είναι 7,8 * 10 mol*L*atm.
Cg =k * Pg
Συγκέντρωση =7,8 * 10 (mol*Latm) * 3 atm
Συγκέντρωση =2,34 * 10 mol/L
Θυμηθείτε να δίνετε προσοχή στις μονάδες σε αυτά τα προβλήματα. Η μερική μας πίεση δόθηκε σε atm, επομένως στο πρόβλημα χρησιμοποιήστε τη σταθερά του Henry που χρησιμοποιεί τις μονάδες της atm.
Ερώτηση #2: Υπολογίστε τη μερική πίεση του μεθανίου στον αέρα εάν η συγκέντρωση σε ένα δείγμα νερού έχει συγκέντρωση 7,8 * 10 mol/L.
Απάντηση και λύση #2: Σε αυτό το πρόβλημα λύνουμε για μερική πίεση. Ξεκινάμε λοιπόν αναδιατάσσοντας την εξίσωσή μας.
Cg =k * Pg
Cg / k =Pg
Στη συνέχεια συνδέουμε τις τιμές που γνωρίζουμε. Η σταθερά προέρχεται από έναν πίνακα τιμών. Αυτό για το μεθάνιο στο νερό βρίσκεται στον παραπάνω πίνακα.
(7,8 * 10-4 mol/L) / (1,41 * 10 mol*L*atm) =Pg
Pg =0,55 atm
Ποιος ήταν ο William Henry;
Ο William Henry ήταν Άγγλος χημικός που σπούδασε στις αρχές του 19ου αιώνα. Έζησε από το 1775-1836. Το έργο του επικεντρώθηκε στη διαλυτότητα των αερίων και είχε ως αποτέλεσμα να πάρει το όνομά του ο Νόμος του Ερρίκου.
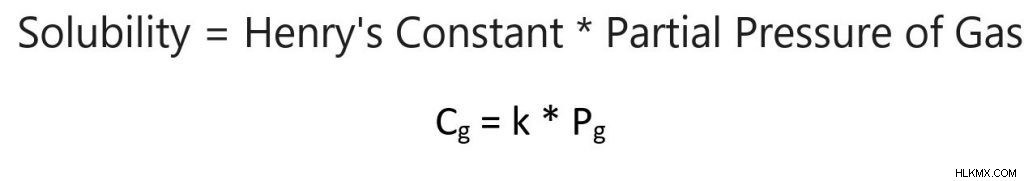
Σύνδεσμοι με άλλους νόμους αερίων και διαλυτότητας
- Συνδυασμένος νόμος για τα αέρια
- Ο νόμος του ιδανικού αερίου
- Νόμος του Μπόιλ
- Σταθερά ισορροπίας
- Νόμος των ομοφυλόφιλων Λουσάκ




