Ποια είναι η διαφορά μεταξύ του στοιχείου μείγματος και της ένωσης;
1. Μείγματα:
* Ορισμός: Ένα μείγμα είναι ένας συνδυασμός δύο ή περισσοτέρων ουσιών όπου κάθε ουσία διατηρεί τις δικές της μεμονωμένες ιδιότητες.
* Βασικά χαρακτηριστικά:
* Τα εξαρτήματα μπορούν εύκολα να διαχωριστούν με φυσικά μέσα (όπως η διήθηση, η εξάτμιση ή ο μαγνητισμός).
* Οι αναλογίες κάθε στοιχείου μπορεί να ποικίλουν.
* Δεν υπάρχει χημική αντίδραση που να εμπλέκεται στο σχηματισμό τους.
* Παραδείγματα: Αλάτι και πιπέρι, άμμο και νερό, αέρας (άζωτο, οξυγόνο κ.λπ.)
2. Στοιχεία:
* Ορισμός: Ένα στοιχείο είναι μια καθαρή ουσία που δεν μπορεί να αναλυθεί σε απλούστερες ουσίες με συνηθισμένα χημικά μέσα.
* Βασικά χαρακτηριστικά:
* Αποτελείται μόνο από έναν τύπο ατόμου.
* Βρέθηκε στον περιοδικό πίνακα.
* Δεν μπορεί να αναλυθεί περαιτέρω από χημικές αντιδράσεις.
* Παραδείγματα: Χρυσός (AU), οξυγόνο (Ο), υδρογόνο (Η)
3. Ενώσεις:
* Ορισμός: Μια ένωση σχηματίζεται όταν δύο ή περισσότερα διαφορετικά στοιχεία συνδυάζονται χημικά σε σταθερή αναλογία.
* Βασικά χαρακτηριστικά:
* Τα συστατικά είναι χημικά συνδεδεμένα μεταξύ τους, δημιουργώντας μια νέα ουσία με διαφορετικές ιδιότητες.
* Μπορεί να διαχωριστεί μόνο με χημικές αντιδράσεις.
* Ο λόγος των στοιχείων είναι σταθερή και σαφής.
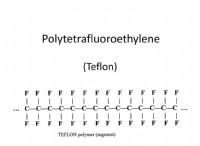
* Παραδείγματα: Νερό (H₂O), διοξείδιο του άνθρακα (CO₂), χλωριούχο νάτριο (NaCl)
Εδώ είναι ένας πίνακας που συνοψίζει τις βασικές διαφορές:
| Χαρακτηριστικό | Μείγμα | Στοιχείο | Ένωση |
| -------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------
| Σύνθεση | Δύο ή περισσότερες ουσίες σε συνδυασμό | Ένας τύπος ατόμου | Δύο ή περισσότερα στοιχεία χημικά συνδυασμένα |
| Ιδιότητες | Τα εξαρτήματα διατηρούν μεμονωμένες ιδιότητες | Μοναδικές ιδιότητες | Ιδιότητες διαφορετικές από τα στοιχεία
| Διαχωρισμός | Εύκολο με φυσικά μέσα | Δεν μπορεί να κατανεμηθεί περαιτέρω | Μπορεί να διαχωριστεί μόνο με χημικά μέσα |
| αναλογία | Μεταβλητές αναλογίες | Σταθερό (ένας τύπος ατόμου) Σταθερό και συγκεκριμένο |
| Παραδείγματα | Αλάτι και πιπέρι, αέρα, άμμο και νερό | Χρυσό, οξυγόνο, υδρογόνο | Νερό, διοξείδιο του άνθρακα, χλωριούχο νάτριο |
ουσιαστικά:
* Μείγματα είναι απλά μείγματα, με τα εξαρτήματα να διατηρούν την ταυτότητά τους.
* Στοιχεία είναι τα δομικά στοιχεία της ύλης, η πιο αγνή μορφή μιας ουσίας.
* ενώσεις σχηματίζονται από στοιχεία που αντιδρούν χημικά και δημιουργούν κάτι εντελώς νέο.