Τι είναι το pOH; Ορισμός και Υπολογισμός
Το pOH και το pH είναι τρόποι για να περιγράψουμε πόσο όξινο ή βασικό είναι ένα υδατικό διάλυμα. Εδώ είναι ο ορισμός του pOH, μια ματιά στο πώς σχετίζονται το pOH και το pH και παραδείγματα υπολογισμού του pOH.
Ορισμός pOH
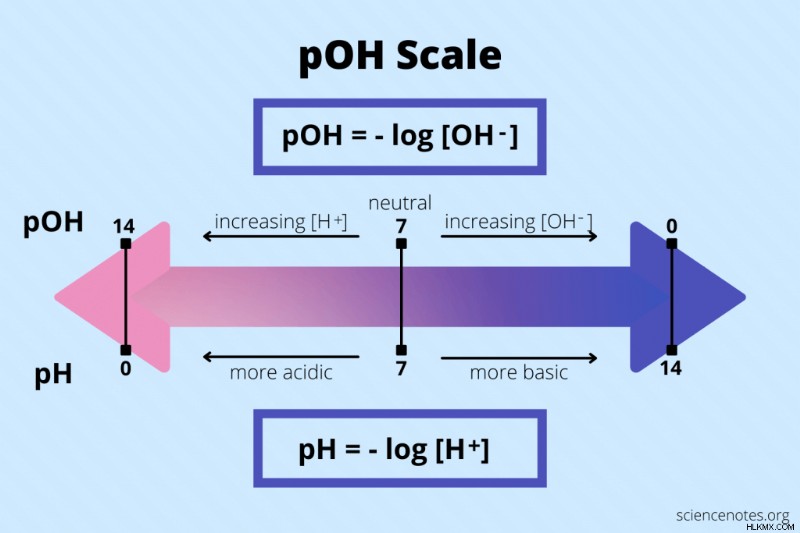
Το pOH ενός υδατικού διαλύματος είναι ο αρνητικός λογάριθμος της συγκέντρωσης ιόντων υδροξειδίου (ΟΗ).
pOH =-log[OH ]
Όπως και με το pH, οι τιμές pOH κυμαίνονται από 1 έως 14, όπου το 7 είναι ουδέτερο. Οι κλίμακες για το pH και το pOH είναι αντίθετες μεταξύ τους. Μια χαμηλή τιμή pOH υποδηλώνει υψηλή βασικότητα της αλκαλικότητας, ενώ μια υψηλή τιμή pOH υποδηλώνει υψηλή οξύτητα. Αντίθετα, ένα χαμηλό pH υποδηλώνει υψηλή οξύτητα, ενώ ένα υψηλό pH υποδηλώνει υψηλή βασικότητα.
Γιατί να χρησιμοποιήσετε pOH;
Ίσως αναρωτιέστε γιατί να θέλετε να χρησιμοποιήσετε το pOH, καθώς το pH είναι ήδη ένας τόσο εύχρηστος τρόπος περιγραφής οξέων και βάσεων. Η κύρια χρήση του pOH είναι η εύρεση συγκέντρωσης ιόντων υδροξειδίου όταν είναι γνωστό το pH ενός διαλύματος. Επίσης, είναι πιο εύκολο να υπολογίσετε το pOH μιας βάσης και στη συνέχεια να υπολογίσετε το pH της.
Πώς σχετίζονται το pH και το pOH
Το pH και το pOH σχετίζονται. Καθώς το pH αυξάνεται, το pOH μειώνεται. Καθώς το pH μειώνεται, το pOH αυξάνεται.
- pH + pOH =14 (στους 25° C)
- pH =14 – pOH
- pOH =14 – pH
Πώς να βρείτε το pOH
Οι δύο τρόποι εύρεσης του pOH είναι από τη συγκέντρωση ιόντων υδροξειδίου ή από μια γνωστή τιμή pH.
Εύρεση pOH από συγκέντρωση ιόντων υδροξειδίου
Εάν γνωρίζετε τη μοριακότητα ενός διαλύματος βάσης, συνδέστε το ως συγκέντρωση ιόντων υδροξειδίου στον τύπο pOH.
Για παράδειγμα, βρείτε το pOH ενός διαλύματος NaOH 0,25 M.
Το κλειδί εδώ είναι να αναγνωρίσουμε ότι το υδροξείδιο του νατρίου είναι μια ισχυρή βάση, επομένως η συγκέντρωσή του είναι η συγκέντρωση ιόντων υδροξειδίου του. Αυτό συμβαίνει επειδή το υδροξείδιο του νατρίου διασπάται πλήρως στα ιόντα του στο νερό:
NaOH(aq ) → Na(aq )+OH(aq )
Με άλλα λόγια, για κάθε mole NaOH, υπάρχει ένα mole ΟΗ σε διάλυμα. Το NaOH και το ιόν υδροξειδίου έχουν τις ίδιες τιμές συγκέντρωσης:
[NaOH] =[OH]
Επομένως, απλά χρησιμοποιήστε τη συγκέντρωση υδροξειδίου του νατρίου στον τύπο pOH:
pOH =-log[OH ]
pOH =-log (0,25)
pOH =0,60
Σκεφτείτε την απάντηση και αν έχει νόημα. Αυτό είναι ένα διάλυμα ισχυρής βάσης, επομένως αναμένετε ότι έχει υψηλή τιμή pH ή χαμηλή τιμή pOH. Ένα pOH 0,60 είναι πολύ χαμηλό, οπότε η απάντηση είναι λογική!
Εάν σας δοθεί η συγκέντρωση ενός οξέος, υπολογίστε πρώτα το pH και μετά χρησιμοποιήστε την τιμή για να βρείτε το pOH.
Εύρεση pOH από pH
Για παράδειγμα, βρείτε το pOH ενός διαλύματος με pH 3,5.
pH + pOH =14
pOH =14 – pH
pOH =14 – 3,5
pOH =10,5
Αναφορές
- Covington, A. K.; Bates, R. G.; Durst, R. Α. (1985). «Ορισμοί κλίμακες pH, τυπικές τιμές αναφοράς, μέτρηση pH και σχετική ορολογία». Pure Appl. Chem . 57 (3):531–542. doi:10.1351/pac198557030531
- Feldman, Isaac (1956). «Χρήση και κατάχρηση μετρήσεων pH». Αναλυτική Χημεία . 28 (12):1859–1866. doi:10.1021/ac60120a014
- Mendham, J.; Denney, R. C.; Barnes, J. D.; Thomas, M. J. K. (2000). Ποσοτική Χημική Ανάλυση του Vogel (6η έκδ.). Νέα Υόρκη:Prentice Hall. ISBN 0-582-22628-7.




