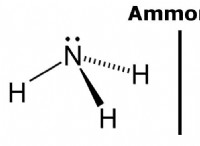
Μπορεί η αμμωνία να χωριστεί από μια χημική αντίδραση;
* Θερμική αποσύνθεση: Η αμμωνία θέρμανσης σε υψηλές θερμοκρασίες (περίπου 450-500 ° C) παρουσία καταλύτη μπορεί να το αποσυντίθεσε σε αέρια αζώτου και υδρογόνου:
2 NH3 (g) → N2 (g) + 3 h2 (g)
* ηλεκτρόλυση: Η διέλευση ενός ηλεκτρικού ρεύματος μέσω ενός διαλύματος αμμωνίας μπορεί να το σπάσει σε άζωτο και υδρογόνο:
2 NH3 (aq) → N2 (g) + 3 h2 (g)
* Αντίδραση με ισχυρά οξέα: Η αμμωνία αντιδρά με ισχυρά οξέα για να σχηματίσει άλατα αμμωνίου και νερό. Ενώ αυτό δεν είναι τεχνικά "σπάσιμο" το μόριο αμμωνίας, αλλάζει τη χημική του σύνθεση. Για παράδειγμα:
NH3 (aq) + HCl (aq) → NH4CL (aq)
* Αντίδραση με οξειδωτικά παράγοντες: Η αμμωνία μπορεί να αντιδράσει με ισχυρούς οξειδωτικούς παράγοντες όπως το χλώριο για να σχηματίσει αέριο αζώτου και άλλα προϊόντα:
2 NH3 (g) + 3 cl2 (g) → N2 (g) + 6 HCl (g)
Η συγκεκριμένη αντίδραση και οι συνθήκες που απαιτούνται για τη διάσπαση της αμμωνίας θα εξαρτηθούν από το επιθυμητό αποτέλεσμα. Για παράδειγμα, η θερμική αποσύνθεση χρησιμοποιείται συχνά για την παραγωγή αερίου υδρογόνου, ενώ η ηλεκτρόλυση μπορεί να χρησιμοποιηθεί για τη μελέτη των ιδιοτήτων της αμμωνίας.