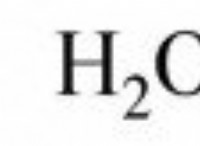Ποιοι τύποι στοιχείων συναντώνται για να σχηματίσουν ιοντικές ενώσεις;
Ακολουθεί μια κατανομή των τύπων στοιχείων που εμπλέκονται:
κατιόντα:
* μέταλλα: Τα μέταλλα τείνουν να χάνουν ηλεκτρόνια για να σχηματίσουν θετικά φορτισμένα ιόντα. Αυτά περιλαμβάνουν στοιχεία όπως το νάτριο (Na+), το κάλιο (Κ+), το μαγνήσιο (Mg2+), το ασβέστιο (CA2+) και το αλουμίνιο (AL3+).
* Ορισμένα μη μέταλλα: Μερικά μη μέταλλα μπορούν επίσης να σχηματίσουν κατιόντα, όπως το αμμόνιο (NH4+).
Anions:
* Μη μετάλλια: Τα μη μέταλλα τείνουν να κερδίζουν ηλεκτρόνια για να σχηματίσουν αρνητικά φορτισμένα ιόντα. Αυτά περιλαμβάνουν στοιχεία όπως το χλώριο (CL-), το οξυγόνο (Ο2-), το θείο (S2-), το άζωτο (Ν3-) και ο φωσφόρος (p3-).
Βασικά σημεία:
* Μέταλλα και μη μέταλλα: Οι πιο συνηθισμένες ιοντικές ενώσεις σχηματίζονται από μέταλλο και μη μέταλλο.
* Ηλεκτροστατική έλξη: Η ισχυρή ηλεκτροστατική έλξη μεταξύ αντίθετα φορτισμένων ιόντων συγκρατεί την ένωση μαζί.
* Ιονικά ομόλογα: Οι δεσμοί που σχηματίζονται σε ιοντικές ενώσεις ονομάζονται ιοντικοί δεσμοί.
* ουδέτερη ένωση: Οι ιοντικές ενώσεις έχουν πάντα ένα ουδέτερο φορτίο συνολικά, πράγμα που σημαίνει ότι το συνολικό θετικό φορτίο από τα κατιόντα ισούται με το συνολικό αρνητικό φορτίο από τα ανιόντα.
Παράδειγμα:
Το χλωριούχο νάτριο (NaCl) είναι ένα κλασικό παράδειγμα ιοντικής ένωσης. Το νάτριο (Na) είναι ένα μέταλλο που χάνει ένα ηλεκτρόνιο για να σχηματίσει ένα κατιόν νατρίου (Na+). Το χλώριο (CL) είναι ένα μη μέταλλο που κερδίζει ένα ηλεκτρόνιο για να σχηματίσει ένα χλωριούχο ανιόν (CL-). Αυτά τα ιόντα προσελκύουν ο ένας τον άλλον για να σχηματίσουν το σύνθετο χλωριούχο νάτριο.