Τι είδους δεσμοί σχηματίζονται με ηλεκτροαρνητικότητα;
1. Ομοιοπολικοί δεσμοί:
* μη πολική ομοιοπολική: Όταν δύο άτομα έχουν παρόμοιες τιμές ηλεκτροαρνητικότητας , μοιράζονται τα ηλεκτρόνια εξίσου. Αυτό έχει ως αποτέλεσμα έναν μη πολικό ομοιοπολικό δεσμό, όπου η πυκνότητα ηλεκτρονίων είναι ομοιόμορφα κατανεμημένη. Παραδείγματα:H₂ (αέριο υδρογόνου), CL₂ (αέριο χλωρίου), O₂ (αέριο οξυγόνου).
* Polar Covalent: Όταν δύο άτομα έχουν διαφορετικές τιμές ηλεκτροαρνητικότητας , το πιο ηλεκτροαρνητικό άτομο προσελκύει τα κοινόχρηστα ηλεκτρόνια πιο έντονα. Αυτό δημιουργεί ένα μερικό αρνητικό φορτίο (δ-) στο πιο ηλεκτροαρνητικό άτομο και ένα μερικό θετικό φορτίο (Δ+) στο λιγότερο ηλεκτροαρνητικό άτομο. Αυτή η ανομοιόμορφη κατανομή των ηλεκτρονίων οδηγεί σε έναν πολικό ομοιοπολικό δεσμό. Παραδείγματα:HCl (υδρογόνο χλωριούχο), H₂O (νερό), NH₃ (αμμωνία).
2. Ιωνικοί δεσμοί:
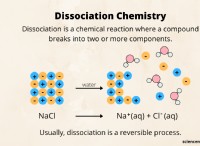
* Ιονικά ομόλογα: Όταν η διαφορά στην ηλεκτροαρνητικότητα μεταξύ δύο ατόμων είναι πολύ μεγάλη , το πιο ηλεκτροαρνητικό άτομο παίρνει εντελώς το ηλεκτρόνιο από το λιγότερο ηλεκτροαρνητικό άτομο. Αυτό έχει ως αποτέλεσμα το σχηματισμό ιόντων:ένα θετικά φορτισμένο κατιόν (απώλεια ηλεκτρονίων) και ένα αρνητικά φορτισμένο ανιόν (κέρδος ηλεκτρονίων). Αυτά τα αντίθετα φορτισμένα ιόντα στη συνέχεια προσελκύονται μεταξύ τους μέσω ηλεκτροστατικών δυνάμεων, σχηματίζοντας ένα ιοντικό δεσμό. Παραδείγματα:NaCl (χλωριούχο νάτριο), MgO (οξείδιο μαγνησίου), CaCl₂ (χλωριούχο ασβέστιο).
Συνοπτικά:
* Παρόμοια ηλεκτροαρνητικότητα: Μη πολικοί ομοιοπολικοί δεσμοί
* Διαφορετική ηλεκτροαρνητικότητα: Πολικοί ομοιοπολικοί δεσμοί
* Πολύ μεγάλη διαφορά στην ηλεκτροαρνητικότητα: Ιοντικοί δεσμοί
Είναι σημαντικό να θυμάστε ότι η διάκριση μεταξύ των τύπων δεσμών δεν είναι πάντα απόλυτη. Υπάρχει μια συνέχεια τύπων ομολόγων και ορισμένοι δεσμοί μπορεί να έχουν χαρακτηριστικά τόσο της ομοιοπολικής όσο και της ιοντικής σύνδεσης.