Διάσπαση (Χημεία) – Ορισμός και Παραδείγματα
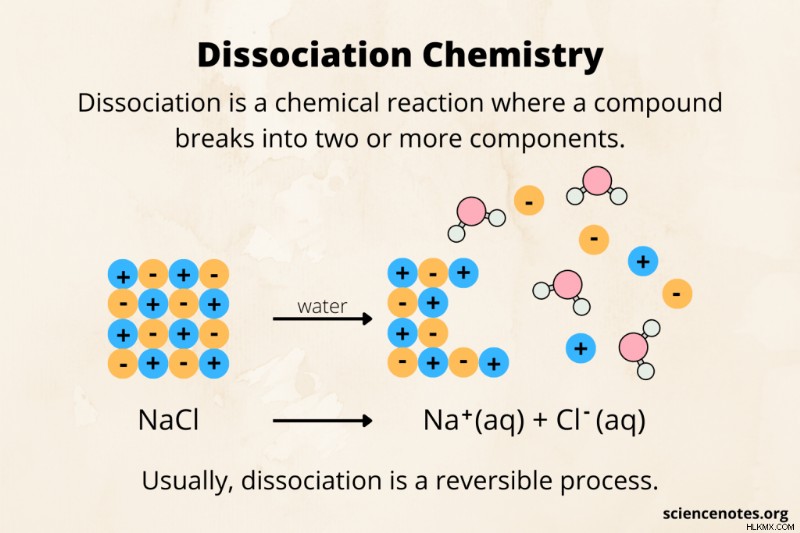
Στη χημεία, η διάσπαση είναι μια χημική αντίδραση κατά την οποία ένα μόριο ή μια ένωση διασπάται σε μικρότερα κομμάτια, όπως ιόντα, άτομα ή ρίζες. Για παράδειγμα, το υδροχλωρικό οξύ (HCl) διασπάται στο νερό, σχηματίζοντας τα ιόντα Η και Cl. Συνήθως, η διάσπαση είναι μια αναστρέψιμη διαδικασία. Το αντίστροφο της διάσπασης είναι η σύνδεση ή ανασυνδυασμό .
Τύπος διάσπασης
Ο γενικός τύπος για μια διάσταση είναι η αντίδραση:
AB ⇄ A + B
Σημειώστε το βέλος της αντίδρασης, υποδεικνύοντας ότι η αντίδραση είναι αναστρέψιμη. Τις περισσότερες φορές, η αντίδραση σχηματίζει κατιόντα και ανιόντα:
AB ⇄ A + B
Το σπάσιμο σε περισσότερα από δύο κομμάτια συμβαίνει σε ορισμένες ενώσεις.
Παραδείγματα αντιδράσεων διάσπασης
Ακολουθούν παραδείγματα αντιδράσεων διάστασης:
- NaCl(s) ⇄ Na(aq) + Cl(aq)
- HCl ⇄ H(aq) + Cl(aq)
- H2 SO4 ⇄ 2H(aq) + SO4 (aq)
- Φε2 (SO4 )3 (s) ⇄ 2Fe(aq) + 3SO4 (aq)
- 2 H2 O ⇄ H3 O+ + OH
Όταν μια μοριακή διάσταση σχηματίζει ιοντικά προϊόντα, ένα άλλο όνομα για την αντίδραση είναι ιονισμός . Κατά σύμβαση, το νερό δεν αναφέρεται ως προϊόν για αντιδράσεις σε υδατικό διάλυμα. Αντίθετα, η συντομογραφία (aq) ακολουθεί τον τύπο του προϊόντος.
Τα αέρια υφίστανται επίσης διάσπαση. Για παράδειγμα, τετροξείδιο του διαζώτου (N2 O4 ) διασπάται σε διοξείδιο του αζώτου (NO2). ), σχηματίζοντας ένα ηλεκτρικά ουδέτερο προϊόν:
N2 O4 ⇄ 2 ΟΧΙ2
Ορισμένες ενώσεις έχουν επιλογές σχετικά με τη διάσπαση και μπορούν να σχηματίσουν μια ποικιλία προϊόντων. Για παράδειγμα azo-t -το βουτάνιο υφίσταται τρεις πιθανές αντιδράσεις διάστασης, σχηματίζοντας ιονισμένο βουτένιο, το t -κατιόν βουτυλίου συν μια ουδέτερη ρίζα, ή ένα διαφορετικό κατιόν συν ένα ουδέτερο t -ρίζα βουτυλίου.
Σταθερά διάσπασης
Εάν όλη μια ένωση διαχωρίζεται, αυτό είναι πλήρης διάσπαση. Οι ισχυροί ηλεκτρολύτες υφίστανται πλήρη διάσπαση στο νερό. Παραδείγματα ισχυρών ηλεκτρολυτών περιλαμβάνουν ισχυρά οξέα, ισχυρές βάσεις και άλατα. Ωστόσο, η ατελής διάσπαση είναι κοινή. Η ατελής διάσπαση οδηγεί σε μείγμα που περιέχει μέρος της αρχικής ένωσης, καθώς και μερικά μικρότερα σωματίδια. Ατελής διάσταση συμβαίνει με ασθενείς ηλεκτρολύτες. Οι αδύναμοι ηλεκτρολύτες περιλαμβάνουν ασθενή οξέα και βάσεις και περισσότερες οργανικές ενώσεις.
Η διαλυτότητα επηρεάζει την ποσότητα του διαχωρισμένου προϊόντος. Για παράδειγμα, ορισμένα άλατα είναι σχεδόν αδιάλυτα, αλλά είναι ισχυροί ηλεκτρολύτες. Για παράδειγμα, ο χλωριούχος άργυρος (AgCl) είναι ένας ισχυρός ηλεκτρολύτης, αλλά είναι πρακτικά αδιάλυτος στο νερό. Ένα κορεσμένο διάλυμα AgCl περιέχει μόνο περίπου 1,3 x 10 M ιόντα Ag και Cl!
Ο βαθμός διάσπασης (α) είναι το κλάσμα μιας ένωσης που διασπάται στα συστατικά της. Έτσι, για παράδειγμα, η πλήρης διάσταση έχει βαθμό διάστασης 1. Αν το ήμισυ μιας σύνθετης διάστασης, ο βαθμός διάστασης είναι 0,5. Εάν δεν υπάρχει διάσταση, ο βαθμός διάστασης είναι 0.
Ο παράγοντας van’t Hoff (i περιγράφει τη σχέση μεταξύ του βαθμού διάστασης (α) και του αριθμού των γραμμομορίων σωματιδίων που σχηματίζονται (n):
i =1 + α(n – 1)
Για παράδειγμα, εξετάστε τη διάσταση του χλωριούχου νατρίου:
NaCl ⇄ Na + Cl
Ένα mole NaCl αποδίδει δύο mole προϊόντων (1 mole Na συν 1 mole Cl). Άρα, n =2.
i =1 + α(n – 1) =1 + α(2 – 1) =1 + α
α =i – 1
Σταθερά διάσπασης
Για μια αναστρέψιμη διάσταση σε χημική ισορροπία, η σταθερά διάστασης (Κδ ) είναι η αναλογία της πολύ αδιάσπαστης ένωσης. Οι αγκύλες υποδεικνύουν τη συγκέντρωση ισορροπίας κάθε χημικού είδους.
AB ⇄ A + B
Kd =[A][B] / [AB]
Αναφορές
- Atkins, P.; de Paula, J. (2006). Φυσική χημεία (8η έκδ.). W.H. Φρίμαν. ISBN 978-0-7167-8759-4.
- Laidler, K.J. (1978). Φυσική χημεία με βιολογικές εφαρμογές . Μπέντζαμιν/Κάμινγκς. ISBN 978-0-8053-5680-9.
- Petrucci, Ralph H.; Harwood, William S.; Herring, F. Geoffrey (2002). Γενική Χημεία:Αρχές και Σύγχρονες Εφαρμογές (8η έκδ.). Upper Saddle River, N.J:Prentice Hall. ISBN 978-0-13-014329-7.




