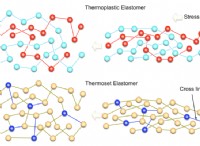
Ποιες είναι μερικές ιδιότητες της μοριακής σύνδεσης;
Ιδιότητες της μοριακής σύνδεσης:
Η μοριακή σύνδεση είναι η δύναμη έλξης που συγκρατεί τα άτομα μαζί για να σχηματίσουν μόρια. Αυτοί οι δεσμοί έχουν διάφορες ιδιότητες, οι οποίες μπορούν να ταξινομηθούν ως:
1. Τύποι ομολόγων:
* ομοιοπολικός δεσμός: Τα άτομα μοιράζονται ηλεκτρόνια για να επιτύχουν μια σταθερή διαμόρφωση ηλεκτρονίων. Μπορούν να είναι ενιαίοι, διπλοί ή τριπλοί δεσμοί ανάλογα με τον αριθμό των κοινόχρηστων ηλεκτρονίων.
* Polar Covalent: Τα ηλεκτρόνια μοιράζονται άνισα, οδηγώντας σε ένα μερικό θετικό και μερικό αρνητικό φορτίο στα άτομα.
* μη πολική ομοιοπολική: Τα ηλεκτρόνια μοιράζονται εξίσου, με αποτέλεσμα τον διαχωρισμό του φορτίου.
* Ιονικός δεσμός: Ένα άτομο δωρίζει ένα ηλεκτρόνιο σε ένα άλλο άτομο, σχηματίζοντας αντίθετα φορτισμένα ιόντα που προσελκύονται μεταξύ τους.
* Μεταλλικός δεσμός: Μια "θάλασσα" των απομακρυσμένων ηλεκτρονίων συγκρατεί τα μέταλλα άτομα μαζί, επιτρέποντας την υψηλή αγωγιμότητα και την ευελιξία.
* δεσμός υδρογόνου: Ένας ειδικός τύπος αλληλεπίδρασης διπολικού-δίπολου μεταξύ ενός ατόμου υδρογόνου που συνδέεται με ένα εξαιρετικά ηλεκτροαρνητικό άτομο (όπως το οξυγόνο ή το άζωτο) και ένα άλλο ηλεκτροαρνητικό άτομο.
2. Δύναμη δεσμού:
* Ενέργεια δεσμού: Η ποσότητα ενέργειας που απαιτείται για να σπάσει ένας συγκεκριμένος δεσμός. Οι ισχυρότεροι δεσμοί έχουν υψηλότερες ενέργειες ομολόγων.
* Μήκος δεσμού: Η απόσταση μεταξύ των πυρήνων δύο συνδεδεμένων ατόμων. Οι βραχύτεροι δεσμοί είναι συνήθως ισχυρότεροι.
* Παραγγελία δεσμού: Ο αριθμός των ζευγών ηλεκτρονίων που μοιράζονται μεταξύ δύο ατόμων. Η υψηλότερη σειρά ομολόγων υποδεικνύει έναν ισχυρότερο δεσμό.
3. Μοριακή γεωμετρία:
* Σχήμα: Η διάταξη των ατόμων σε ένα μόριο, που καθορίζεται από την απόρριψη μεταξύ ζευγών ηλεκτρονίων.
* γωνία: Η γωνία μεταξύ δύο δεσμών σε ένα μόριο, που επηρεάζεται επίσης από την απόρριψη ηλεκτρονίων.
* υβριδοποίηση: Η ανάμειξη ατομικών τροχιακών για να σχηματίσουν υβριδικά τροχιακά που είναι πιο κατάλληλα για συγκόλληση.
4. Πολικότητα:
* Διπολική στιγμή: Ένα μέτρο του διαχωρισμού φορτίου σε ένα μόριο.
* πολικό μόριο: Ένα μόριο με σημαντική διπολική στιγμή, που προκύπτει από ανομοιογενή κατανομή φορτίου.
* μη πολικό μόριο: Ένα μόριο χωρίς καθαρή διπολική στιγμή, λόγω συμμετρικής κατανομής φορτίου.
5. Διαμοριακές δυνάμεις:
* Van der Waals Δυνάμεις: Αδύνατα αξιοθέατα μεταξύ μορίων, συμπεριλαμβανομένων των δυνάμεων διασποράς του Λονδίνου και των αλληλεπιδράσεων διπολικού διπόλου.
* δεσμός υδρογόνου: Ένας ισχυρότερος τύπος διαμοριακής δύναμης, ζωτικής σημασίας για ιδιότητες όπως το υψηλό σημείο βρασμού του νερού.
6. Φυσικές ιδιότητες:
* Σημεία τήξης και βρασμού: Αυτά επηρεάζονται από τη δύναμη των διαμοριακών δυνάμεων. Οι ισχυρότερες δυνάμεις οδηγούν σε υψηλότερα σημεία τήξης και βρασμού.
* Διαλυτότητα: Η ικανότητα μιας ουσίας να διαλύεται σε μια άλλη ουσία, που συχνά επηρεάζεται από την πολικότητα και των δύο ουσιών.
* Αντιδραστικότητα: Η τάση ενός μορίου να υποβληθεί σε χημικές αντιδράσεις, εξαρτώμενη από τον τύπο του δεσμού και την παρουσία λειτουργικών ομάδων.
Η κατανόηση αυτών των ιδιοτήτων της μοριακής σύνδεσης είναι ζωτικής σημασίας για την κατανόηση της συμπεριφοράς και των ιδιοτήτων των διαφορετικών ουσιών, η οποία είναι απαραίτητη σε διάφορους τομείς όπως η χημεία, η βιολογία και η επιστήμη των υλικών.