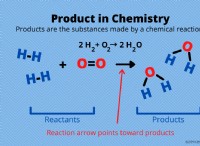
Πώς μπορείτε να χρησιμοποιήσετε το νόμο της μάζας συνομιλίας για να εξισορροπήσετε μια χημική εξίσωση;
Δείτε πώς αυτή η αρχή βοηθά στην εξισορρόπηση των χημικών εξισώσεων:
1. Προσδιορίστε τα στοιχεία: Ξεκινήστε αναφέροντας όλα τα στοιχεία που υπάρχουν στα αντιδραστήρια και τα προϊόντα.
2. Μετρήστε τον αριθμό των ατόμων κάθε στοιχείου και στις δύο πλευρές της εξίσωσης.
3. Ρυθμίστε τους συντελεστές: Για να διασφαλιστεί ότι ο αριθμός των ατόμων κάθε στοιχείου είναι ο ίδιος και από τις δύο πλευρές, θα πρέπει να προσαρμόσετε τους συντελεστές μπροστά σε κάθε χημικό τύπο. Οι συντελεστές αντιπροσωπεύουν τον αριθμό των μορίων κάθε ουσίας που εμπλέκεται στην αντίδραση.
Παράδειγμα:
Ας δούμε την μη ισορροπημένη εξίσωση για την καύση του μεθανίου:
ch₄ + o₂ → co₂ + h₂o
* Βήμα 1: Τα στοιχεία είναι άνθρακα (C), υδρογόνο (Η) και οξυγόνο (Ο).
* Βήμα 2:
* Αντιδραστήρια:1 c, 4 ώρες, 2 o
* Προϊόντα:1 C, 2 h, 3 o
* Βήμα 3: Για να εξισορροπήσετε, προσαρμόστε τους συντελεστές:
* 1ch₄ + 2o₂ → 1co₂ + 2h₂o
Τώρα, ο αριθμός των ατόμων κάθε στοιχείου είναι ίσος και από τις δύο πλευρές:
* Αντιδραστήρια: 1 C, 4 ώρες, 4 o
* Προϊόντα: 1 C, 4 ώρες, 4 o
Οι χημικές εξισώσεις εξισορρόπησης είναι απαραίτητες:
* Εξασφαλίζει ότι ο νόμος της διατήρησης της μάζας διατηρείται.
* Δίνει ακριβείς στοιχειομετρικές αναλογίες, οι οποίες είναι ζωτικής σημασίας για:
* Προβλέποντας τις ποσότητες των αντιδραστηρίων και των προϊόντων που εμπλέκονται σε μια αντίδραση.
* Υπολογισμός των θεωρητικών αποδόσεων σε χημικές αντιδράσεις.
* Κατανόηση των ποσοτικών σχέσεων μεταξύ ουσιών σε χημικές αντιδράσεις.
Επιτρέψτε μου να ξέρω αν θέλετε να δείτε περισσότερα παραδείγματα εξισορρόπησης χημικών εξισώσεων!