Συλλογικές ιδιότητες
Βασικές έννοιες
Σε αυτό το σεμινάριο, θα μάθετε για 3 συλλογικές ιδιότητες :μείωση της πίεσης ατμών, ανύψωση σημείου βρασμού και κατάθλιψη σημείου πήξης! Θα μάθετε επίσης πληροφορίες για την κατανόηση του περιεχομένου.
Θέματα που καλύπτονται σε άλλα άρθρα
- Φυσικές έναντι χημικών ιδιοτήτων
- Κατάσταση ύλης
- Ιδιότητες στερεών, υγρών και αερίων
- Διαγράμματα φάσεων
Έννοιες που σχετίζονται με συλλογικές ιδιότητες
Πριν διαβάσετε για αυτό το θέμα, πρώτα βεβαιωθείτε ότι έχετε διαβάσει και κατανοήσει αυτήν την ενότητα για να κατανοήσετε πλήρως το σεμινάριο!
Νόμος του Raoult
Ο François-Marie Raoult ήταν Γάλλος χημικός γεννημένος στο Fournes και δημιούργησε τον «νόμο του Raoult». αυτός ο νόμος εστιάζει στην υποπίεση των σημείων πήξης και στην τάση ατμών των διαλυμάτων.
P(λύση) =χ (διαλύτης) × Pº(διαλύτης)
P(λύση) – τάση ατμών του διαλύματος
χ (διαλύτης) – γραμμομοριακό κλάσμα διαλύτη
Pº(διαλύτης) – τάση ατμών καθαρού διαλύτη
Ερρίκος ‘s Νόμος
Ο Γουίλιαμ Χένρι ήταν Άγγλος χημικός γεννημένος στο Μάντσεστερ και δημιούργησε τον «Νόμο του Χένρι». Σύμφωνα με αυτόν τον νόμο, η ποσότητα του διαλυμένου αερίου σε ένα υγρό είναι ανάλογη της μερικής του πίεσης πάνω από το υγρό. Εξαίρεση σε αυτόν τον νόμο είναι όταν το αέριο και το διάλυμα συμμετέχουν σε χημικές αντιδράσεις μεταξύ τους. Εξαιτίας αυτού, ο νόμος του Henry είναι επίσης γνωστός ως ο «περιοριστικός νόμος».
C =k × P(αέριο)
C – συγκέντρωση διαλυμένου αερίου
k – Σταθερά του νόμου του Henry
P(αέριο) – μερική πίεση αερίου
Μοριακότητα έναντι μοριακότητας
- Μοριακότητα (Μ): μοριακή συγκέντρωση διαλύματος. Ο τύπος είναι:M =(mols διαλυμένης ουσίας)/(λίτρα διαλύματος)
- Molality (m): αναλογία mol της ουσίας προς ένα κιλό διαλύτη. Ο τύπος είναι:m =(mols διαλυμένης ουσίας)/ (kg διαλύτη)
Διαλυτότητα
Η διαλυτότητα είναι η ικανότητα μιας ουσίας (στερεής, υγρής ή αερίου) να διαλύεται πλήρως σε έναν διαλύτη. Υπάρχουν πολλοί φυσικοί και χημικοί παράγοντες που επηρεάζουν τη διαλυτότητα.
Για παράδειγμα, το pH και η διαλυτότητα έχουν αντίστροφη σχέση. εάν το pH μιας ουσίας μειωθεί, η διαλυτότητα θα αυξηθεί. Επιπλέον, το μέγεθος και η διαλυτότητα έχουν άμεση σχέση. Όσο μικρότερα είναι τα σωματίδια, τόσο πιο γρήγορα θα διαλυθεί η ουσία λόγω της αυξημένης επιφάνειας έκθεσης στον διαλύτη. Στη συνέχεια, η δομή τόσο του διαλύτη όσο και της διαλυμένης ουσίας μπορεί να παίξει ρόλο στον τρόπο αλληλεπίδρασης τους. Θα πρέπει να έχουν τις ίδιες δομικές ιδιότητες, όπως υδροφοβικότητα, ώστε να αναμιγνύονται μεταξύ τους και να μην απωθούν το ένα το άλλο. Επίσης, η θερμοκρασία θα έχει διαφορετική επίδραση ανάλογα με τη δομή της διαλυμένης ουσίας. Εάν ένα στερεό, όσο υψηλότερη είναι η θερμοκρασία, τόσο πιο γρήγορα θα διαλυθεί. Ωστόσο, στις περιπτώσεις αερίων, όσο χαμηλότερη είναι η θερμοκρασία και υψηλότερη η πίεση, τόσο πιο γρήγορα θα διαλυθεί.
Τι είναι οι συλλογικές ιδιότητες;
Το "Colligative" προέρχεται από τη λατινική λέξη "colligatus" που σημαίνει δεμένοι μεταξύ τους.
Αυτές οι ιδιότητες έχουν φυσικές αλλαγές που επηρεάζονται από τη συγκέντρωση μιας ουσίας. Με άλλα λόγια, εξαρτώνται από τη μοριακότητα ή τη μοριακότητα μορίων ή ιόντων διαλυμένης ουσίας. Οι συλλογικές ιδιότητες βασίζονται αποκλειστικά στον αριθμό των διαλυμένων σωματιδίων και δεν εξαρτώνται από τη μοναδική ταυτότητα των σωματιδίων.
Οι συλλογικές ιδιότητες μπορούν να χωριστούν σε πολλαπλές ενότητες, οι οποίες φαίνονται σε όλο το παρακάτω γράφημα:μείωση της τάσης ατμών, ανύψωση του σημείου βρασμού και κατάθλιψη σημείου πήξης. Ας δούμε αναλυτικά καθένα από αυτά!
Μείωση πίεσης ατμών
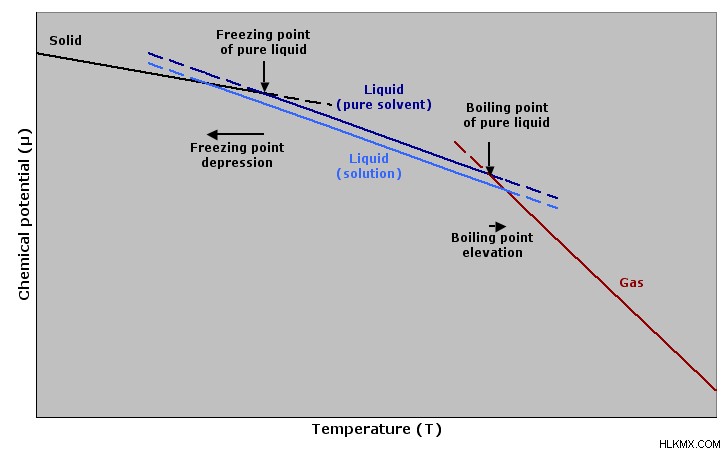
Όταν μια ιοντική ένωση προστίθεται σε έναν διαλύτη, διασπάται. Όταν συμβεί αυτό, το σημείο βρασμού του διαλύματος αυξάνεται και το σημείο πήξης μειώνεται. Στην περίπτωση μιας ουσίας όπως η ζάχαρη, δεν θα διαχωριστεί, αλλά και πάλι, το σημείο βρασμού αυξάνεται και το σημείο πήξης μειώνεται.
Pλύση =χδιαλύτης × P°διαλύτης
Υψόμετρο σημείου βρασμού
Η ανύψωση του σημείου βρασμού σχετίζεται άμεσα με τη μείωση της τάσης ατμών. έχει παρουσία σε κάθε διαλυμένη ουσία σε όλα τα διαλύματα. Καθώς μια άλλη ένωση, μια μη πτητική διαλυμένη ουσία, προστίθεται σε ένα διάλυμα, μια καθαρή διαλυμένη ουσία, το σημείο βρασμού θα αυξηθεί. Όταν συμβεί αυτό, η ουσία υγρή φάση ή αέρια φάση είναι ισοδύναμη από άποψη ενέργειας.
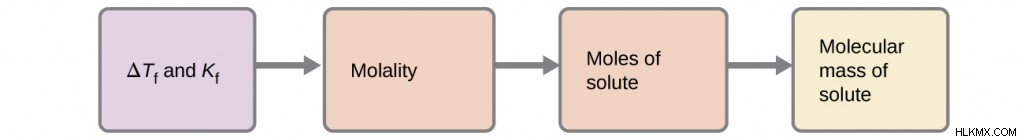
ΔTb =i × Kb × m
ΔTb =μεταβολή στο σημείο βρασμού
i =Συντελεστής Von’t Hoff
Kb =μοριακή σταθερά σημείου βρασμού
m =molality
Πτώση σημείου παγώματος
Σε αυτή την ιδιότητα, οι υγροί διαλύτες και οι στερεοί διαλύτες βρίσκονται σε ισορροπία. Ωστόσο, πριν συμβεί αυτό, είναι απαραίτητο να επιτευχθεί χαμηλότερη θερμοκρασία, ώστε να μπορεί να συμβεί κατάψυξη. Ένα παράδειγμα αυτής της ιδιότητας είναι το παγωτό, καθώς όταν η ζάχαρη διαλύεται με νερό, έναν γενικό διαλύτη, το σημείο πήξης μειώνεται και παρεμποδίζει την κρυστάλλωση λόγω της τροποποίησης του νερού. Τα σωματίδια ζάχαρης παρεμβαίνουν στις ελκτικές δυνάμεις του διαλύτη.
∆TF =KF × μ
∆TF =αλλαγή στο σημείο πήξης
KF =μοριακή σταθερά σημείου πήξης
m=molality

Περαιτέρω ανάγνωση
- Τι είναι μια χημική αντίδραση;
- Τι είναι η σταθερά ισορροπίας;
- Υπολογισμός μοριακής μάζας
- Κοινό φαινόμενο ιόντων




