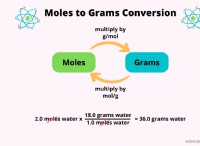
Πώς είναι οι δομές ηλεκτρόνων του υδρογόνου και του λιθίου;
υδρογόνο (h)
* Ατομικός αριθμός: 1
* Διαμόρφωση ηλεκτρονίων: 1S¹
* Επεξήγηση: Το υδρογόνο έχει μόνο ένα πρωτόνιο στον πυρήνα του και επομένως μόνο ένα ηλεκτρόνιο. Αυτό το ηλεκτρόνιο καταλαμβάνει το χαμηλότερο επίπεδο ενέργειας, το 1s τροχιακό.
λίθιο (li)
* Ατομικός αριθμός: 3
* Διαμόρφωση ηλεκτρονίων: 1S² 2S¹
* Επεξήγηση: Το λίθιο έχει τρία πρωτόνια και τρία ηλεκτρόνια. Δύο ηλεκτρόνια γεμίζουν το 1S τροχιακό και το υπόλοιπο ηλεκτρόνιο καταλαμβάνει το τροχιακό 2S.
Οπτικοποίηση των δομών ηλεκτρονίων
Μπορείτε να απεικονίσετε τις δομές ηλεκτρονίων χρησιμοποιώντας ένα απλό διάγραμμα:
υδρογόνο:
* 1s: ⚪️ (ένα ηλεκτρόνιο στο 1S Orbital)
λίθιο:
* 1s: ⚪️⚪ασίας (δύο ηλεκτρόνια στο 1S Orbital)
* 2s: ⚪️ (ένα ηλεκτρόνιο στο 2S Orbital)
Βασικά σημεία
* Orbitals: Τα ηλεκτρόνια καταλαμβάνουν συγκεκριμένες περιοχές χώρου γύρω από τον πυρήνα που ονομάζονται τροχιακά. Το 1S τροχιακό είναι σφαιρικό και είναι το χαμηλότερο επίπεδο ενέργειας. Το τροχιακό 2S είναι επίσης σφαιρικό αλλά σε υψηλότερο επίπεδο ενέργειας.
* Διαμόρφωση ηλεκτρονίων: Η διαμόρφωση ηλεκτρονίων περιγράφει τη διάταξη των ηλεκτρονίων σε τροχιακά ενός ατόμου.
* ηλεκτρόνια σθένους: Τα ηλεκτρόνια στο εξωτερικό επίπεδο ενέργειας (σε αυτή την περίπτωση, το ηλεκτρόνιο 2S για το λίθιο) ονομάζονται ηλεκτρόνια σθένους. Διαδραματίζουν καθοριστικό ρόλο στη χημική σύνδεση.
Επιτρέψτε μου να ξέρω αν θέλετε περισσότερες λεπτομέρειες σε οποιαδήποτε από αυτές τις έννοιες!