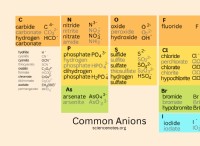
Τι είδους χημικός δεσμός είναι το βαναδικό και ο χαλκός;
* Είναι και τα δύο μέταλλα. Τα μέταλλα συνήθως σχηματίζουν μεταλλικούς δεσμούς μεταξύ τους, που είναι ένα διαφορετικό είδος δεσμού από το ιοντικό ή ομοιοπολικό.
* Οι μεταλλικοί δεσμοί περιλαμβάνουν μια "θάλασσα ηλεκτρονίων." Στη μεταλλική συγκόλληση, τα ηλεκτρόνια σθένους των μεταλλικών ατόμων απομακρύνονται και μοιράζονται μεταξύ όλων των ατόμων της δομής. Αυτό δημιουργεί μια ισχυρή έλξη μεταξύ των θετικά φορτισμένων μεταλλικών ιόντων και των κοινόχρηστων ηλεκτρονίων.
Έτσι, ενώ το βαναδικό και ο χαλκός μπορούν να βρεθούν σε κράματα (μείγματα μετάλλων), δεν σχηματίζουν συγκεκριμένο χημικό δεσμό μεταξύ τους.
Αντ 'αυτού, η αλληλεπίδρασή τους βασίζεται στη μεταλλική σύνδεση μέσα σε κάθε μεμονωμένο μέταλλο και στο φυσικό μίγμα των δύο μετάλλων.