Ποια σχήματα μπορούν να σχηματίσουν μόρια άνθρακα;
1. Γραμμική: Μια απλή, ευθεία διάταξη των ατόμων. Παραδείγματα:
* διοξείδιο του άνθρακα (CO2): O =c =o
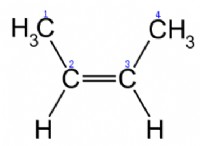
2. Trigonal Planar: Τρία άτομα συνδέονται με ένα κεντρικό άτομο άνθρακα, σχηματίζοντας ένα επίπεδο τρίγωνο. Παραδείγματα:
* μεθάνιο (CH4): Ένα τετραεδρικό σχήμα, αλλά με ένα υδρογόνο αντικαταστάθηκε από ένα άλλο άτομο.
* φορμαλδεΰδη (H2CO): H-c (=o) -h
3. Tetrahedral: Τέσσερα άτομα συνδέονται με ένα κεντρικό άτομο άνθρακα, σχηματίζοντας μια τρισδιάστατη πυραμίδα με τριγωνική βάση. Παραδείγματα:
* μεθάνιο (CH4): Αυτό είναι το πιο βασικό σχήμα, με άνθρακα στο κέντρο και τέσσερα άτομα υδρογόνου στις γωνίες.
* αιθάνιο (C2H6): Δύο τετραεδρικοί άνθρακες που συνδέονται με ένα μόνο δεσμό.
4. Λυγισμένος: Ένα μη γραμμικό σχήμα, που συχνά βρίσκεται σε μόρια με μοναχικά ζεύγη ηλεκτρονίων στο κεντρικό άτομο άνθρακα. Παραδείγματα:
* νερό (H2O): Το άτομο οξυγόνου έχει δύο μοναχικά ζεύγη, προκαλώντας τη γωνία δεσμού H-O-H να είναι μικρότερη από 180 μοίρες.
5. Τριγωνική πυραμιδική: Μια πυραμίδα με τριγωνική βάση, όπως ένα τετράεδρο, αλλά με ένα μοναδικό ζευγάρι ηλεκτρόνων στο κεντρικό άτομο άνθρακα. Παραδείγματα:
* αμμωνία (NH3): Το άζωτο έχει ένα μοναδικό ζεύγος, προκαλώντας τη γωνία δεσμού H-H-H να είναι μικρότερη από 109,5 μοίρες.
6. Κυκλικό: Τα άτομα άνθρακα σχηματίζουν κλειστούς δακτυλίους. Παραδείγματα:
* κυκλοεξάνιο (C6H12): Ένα εξάμηνο δακτύλιο με εναλλασσόμενους μονοκατοικίες και διπλούς δεσμούς.
* Βενζόλιο (C6H6): Ένα εξάμηνο δακτύλιο με αποσυνδεδεμένα ηλεκτρόνια, δίνοντάς του αρωματικές ιδιότητες.
7. Σύνθετες δομές 3D: Ο άνθρακας μπορεί να σχηματίσει πολύ σύνθετες δομές, συμπεριλαμβανομένων των αλυσίδων, των κλάδων και ακόμη και των δικτύων. Παραδείγματα:
* Πολυμερή: Μακρές αλυσίδες επαναλαμβανόμενων μονάδων άνθρακα, όπως το πολυαιθυλένιο.
* fullerenes: Σφαιρικές δομές που μοιάζουν με κλουβί όπως το buckminsterfullerene (C60).
* Graphene: Ένα μόνο στρώμα ατόμων άνθρακα που διατεταγμένα σε πλέγμα κηρήθρας.
Παράγοντες που επηρεάζουν σχήματα μορίων άνθρακα:
* υβριδοποίηση: Η ανάμειξη των ατομικών τροχιακών για να σχηματίσουν νέα, υβριδοποιημένα τροχιακά που επηρεάζουν το σχήμα του μορίου.
* Γωνίες δεσμών: Οι γωνίες μεταξύ των δεσμών, οι οποίες καθορίζονται από την απόρριψη μεταξύ ζευγών ηλεκτρονίων.
* Ζεύγη: Τα μη συνδεδεμένα ζεύγη ηλεκτρονίων στο κεντρικό άτομο άνθρακα μπορούν να επηρεάσουν το σχήμα.
* Διαμοριακές δυνάμεις: Τα αξιοθέατα μεταξύ των μορίων μπορούν να επηρεάσουν το συνολικό σχήμα και δομή.
Η κατανόηση των σχημάτων των μορίων άνθρακα είναι ζωτικής σημασίας για την πρόβλεψη των ιδιοτήτων τους, της αντιδραστικότητας και των βιολογικών λειτουργιών τους.